Kalsiyum peroksit (CaO2), suyla temas ettiğinde oksijen açığa çıkaran kimyasal bir bileşiktir. Toprak ıslahı ve atık su arıtımı da dahil olmak üzere endüstriyel ve tarımsal uygulamalarda yaygın olarak oksitleyici bir madde olarak kullanılır.
| IUPAC Adı | Kalsiyum dioksit |
| Moleküler formül | CaO2 |
| CAS numarası | 1305-79-9 |
| Eş anlamlı | Kalsiyum süperoksit; Kalsiyum dioksit peroksit; CP |
| InChI | InChI=1S/Ca.O2/c;1-2/q+2;-2 |
Kalsiyum peroksitin özellikleri
Kalsiyum peroksit formülü
Kalsiyum peroksitin kimyasal formülü CaO2’dir; bu, bileşiğin bir kalsiyum atomu ve iki oksijen atomu içerdiğini gösterir. Formül, bileşiğin bileşiminin bir temsilidir ve maddenin molar kütlesinin ve diğer özelliklerinin belirlenmesinde faydalıdır. Kalsiyum peroksit, toprak ıslahı, atık su arıtımı ve oksijen gazı üretimi dahil olmak üzere çeşitli endüstriyel ve tarımsal uygulamalarda yaygın olarak oksitleyici bir madde olarak kullanılır.
Kalsiyum Peroksit Molar Kütlesi
CaO2 kimyasal formülüyle temsil edilen kalsiyum peroksitin molar kütlesi 72.077 g/mol’dür. Molar kütle, bir maddenin bir molünün kütlesidir ve kimyasal reaksiyonlarda genellikle kütle ve mol arasında dönüşüm yapmak için kullanılır. CaO2’nin molar kütlesini bilmek, belirli bir reaksiyon için maddenin ne kadarının gerekli olduğunu belirlemede faydalıdır.
Kalsiyum peroksitin kaynama noktası
CaO2 katı bir bileşiktir ve geleneksel anlamda kaynama noktası yoktur. Bunun yerine, ısıtıldığında termal ayrışmaya uğrar, oksijen gazı açığa çıkar ve arkasında kalsiyum oksit bırakır. Bu işlem 150°C’nin (302°F) üzerindeki sıcaklıklarda gerçekleşir.
Kalsiyum Peroksitin Erime Noktası
CaO2’nin katı halden sıvı hale geçtiği sıcaklık olan erime noktası yaklaşık 350°C’dir (662°F). Bu yüksek erime noktası, bileşiğin kalsiyum ve oksijen atomları arasındaki güçlü iyonik bağlardan kaynaklanmaktadır.
Kalsiyum peroksit yoğunluğu g/mL
CaO2’nin yoğunluğu 2,91 g/mL’dir. Yoğunluk, birim hacim başına kütle miktarının bir ölçüsüdür ve bir maddenin ne kadar yer kapladığını belirlemede faydalıdır.
Kalsiyum Peroksit Molekül Ağırlığı
CaO2’nin moleküler ağırlığı 72.077 g/mol’dür. Bu değer, CaO2 kimyasal formülündeki tüm atomların atom ağırlıkları toplanarak hesaplanır.
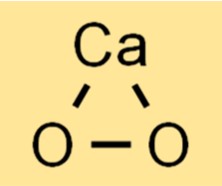
Kalsiyum peroksitin yapısı
CaO2, her bir kalsiyum iyonunun altı oksijen atomu ile çevrelendiği bir kristal yapıya sahiptir. Oksijen atomları, kalsiyum iyonunun etrafında tetrahedral bir geometride düzenlenir; her oksijen, kalsiyum iyonu ile kovalent bir bağ oluşturur. Bileşik beyaz veya sarımsı bir renge sahiptir ve suda çözünmez.
| Dış görünüş | Beyaz toz |
| Spesifik yoğunluk | 2,91 gr/cm³ |
| Renk | Beyaz veya sarımsı |
| Koku | Kokusuz |
| Molar kütle | 72.077 gr/mol |
| Yoğunluk | 2,91 gr/ml |
| Füzyon noktası | ~350°C (662°F) |
| Kaynama noktası | 150°C’nin (302°F) üzerinde ayrışır |
| Flaş noktası | Yok |
| sudaki çözünürlük | Çözünmez |
| çözünürlük | Organik çözücülerde çözünmez |
| Buhar basıncı | Yok |
| Buhar yoğunluğu | Yok |
| pKa | Yok |
| pH | Yok |
Kalsiyum Peroksit Güvenliği ve Tehlikeleri
CaO2 birçok potansiyel tehlike ve güvenlik kaygısı taşır. Oksitleyici bir maddedir ve yağlar veya yakıtlar gibi organik maddelerle teması halinde yangına veya patlamaya neden olabilir. Ayrıca hidroklorik asit gibi bazı asitlerle şiddetli reaksiyona girebilir. Gözlerle, ciltle veya solunum sistemiyle teması tahrişe neden olabilir ve yutulması veya solunması sağlık üzerinde daha ciddi etkilere neden olabilir. CaO2’yi dikkatli bir şekilde kullanmak ve koruyucu kıyafet ve gözlük takmak ve iyi havalandırılmış bir alanda çalışmak dahil uygun güvenlik prosedürlerini takip etmek önemlidir.
| Tehlike sembolleri | Oksitleyici madde, Tahriş edici |
| Güvenlik Açıklaması | Organik maddelerle temastan kaçının, Koruyucu kıyafet ve gözlük kullanın, İyi havalandırılmış bir alanda çalışın |
| BM kimlik numaraları | UN1457 |
| HS kodu | 2825.90.90 |
| Tehlike sınıfı | 5.1 (Oksitleyici maddeler) |
| Paketleme grubu | III |
| Toksisite | Göz, cilt veya solunum sistemi ile temasında tahrişe neden olabilir. Yutulması veya solunması halinde sağlık üzerinde daha ciddi etkilere neden olabilir. |
Kalsiyum peroksit sentez yöntemleri
CaO2 çeşitli yöntemlerle sentezlenebilir.
Yaygın bir yöntem, CaO’nun su varlığında hidrojen peroksit ile reaksiyonunu içerir. Başka bir yöntem Ca(OH)2’nin hidrojen peroksit ile reaksiyonunu içerir. Her iki durumda da ortaya çıkan ürün CaO2 ve sudur.
Başka bir yöntem Ca(OH)2’nin sodyum peroksit ile reaksiyonunu içerir. Bu CaO2 ve sodyum hidroksit üretir.
CaCl2 ile sodyum peroksit arasındaki reaksiyon da tanıdıktır. Bu CaO2 ve sodyum klorür üretir.
Laboratuvarda CaO2, metalik kalsiyumun oksijen gazıyla reaksiyonundan da üretilebilir. Ancak bu yöntem, metalik kalsiyumun yüksek maliyeti nedeniyle büyük ölçekli üretim için pratik değildir.
Kalsiyum Peroksitin Kullanım Alanları
CaO2’nin çeşitli sektörlerde birçok kullanımı vardır. İşte en yaygın uygulamalardan bazıları:
- Tarım: Toprak temizliğinde oksijen kaynağı olarak ve mahsul koruyucu olarak kullanılır.
- Çevresel İyileştirme: Yavaş oksijen salınımı sağlayarak kirlenmiş toprak ve suyun biyolojik olarak arıtılmasını arttırmak için kullanılır.
- Gıda endüstrisi: Hamur kalitesini arttırmak ve unu beyazlatmak amacıyla gıda katkı maddesi olarak kullanılır.
- Kimyasal sentez: H2O2 ve kalsiyum stearat dahil çeşitli kimyasalların üretiminde kullanılır.
- Polimer üretimi: Polietilen ve diğer plastiklerin üretiminde polimer başlatıcı olarak kullanılır.
- Su Arıtma: Dezenfeksiyon ve koku kontrolü de dahil olmak üzere su arıtımında hidrojen peroksit kaynağı olarak kullanılır.
- Madencilik: Madencilik faaliyetlerinde patlatma maddesi olarak kullanılır.
- Petrol ve gaz endüstrisi: Gelişmiş petrol geri kazanımı ve sülfitlerin ve merkaptanların petrol ve gaz akışlarından uzaklaştırılması için oksijen kaynağı olarak kullanılır.
Sorular:
S: Hidrojen peroksit insan vücudundaki kalsiyum birikintilerini çözebilir mi?
C: Hidrojen peroksit, bazı durumlarda Ca2+ birikintilerinin giderilmesinde etkili olabilir ancak yalnızca bir sağlık uzmanının talimatıyla kullanılmalıdır.
S: Kalsiyum peroksit nereden geliyor?
C: CaO2 ilk kez 1900’lü yılların başında Paul Sabatier adlı Fransız kimyager tarafından keşfedildi.
S: Kalsiyum peroksit nedir?
C: CaO2, çeşitli endüstriyel ve çevresel uygulamalarda oksijen kaynağı olarak kullanılan beyaz veya sarımsı bir tozdur.
S: Kalsiyum peroksit tuzu mu?
C: Hayır, CaO2 bir tuz değildir. Kalsiyum, oksijen ve bazen başka elementleri içeren kimyasal bir bileşiktir.
S: CaO2 nedir?
C: CaO2, kalsiyum peroksitin kimyasal formülüdür.
S: CaO2 ne anlama geliyor?
C: CaO2, kalsiyum peroksit kimyasal bileşiğinin kısaltmasıdır.
