Kalsiyum perklorat (Ca(ClO4)2), havai fişekler ve roket yakıtları da dahil olmak üzere birçok kullanıma sahip kimyasal bir bileşiktir. Suda çok çözünür ve aynı zamanda kurutma maddesi olarak da kullanılabilir.
| IUPAC Adı | Kalsiyum perklorat |
| Moleküler formül | Ca(ClO4)2 |
| CAS numarası | 13477-36-6 |
| Eş anlamlı | Calciofos, perklorik asidin kalsiyum tuzu, kalsiyum diperklorat, kalsiyum (II) perklorat, UN1459 |
| InChI | InChI=1S/Ca.2ClH04/c;2 2-1(3,4)5/h;2 (H,2,3,4,5)/q+2;;/p-2 |
Kalsiyum perkloratın özellikleri
Kalsiyum perklorat formülü
Kalsiyum perkloratın formülü Ca(ClO4)2’dir. Bir Ca2+ iyonu ve iki ClO4- iyonundan oluşur. Kalsiyum iyonu 2+ pozitif yüke sahiptir ve her ClO4- iyonu 1- negatif yüke sahiptir. Bu formül kalsiyum perkloratın kimyasal yapısını temsil etmek için kullanılır.
Kalsiyum Perklorat Molar Kütle
Ca(ClO4)2’nin molar kütlesi 238,98 g/mol’dür. Bu değer, Avogadro sayısı kadar molekül içeren Ca(ClO4)2’nin bir molünün kütlesini temsil eder. Molar kütle, belirli bir reaksiyonda ihtiyaç duyulan Ca(ClO4)2 miktarının belirlenmesinde önemlidir.
Kalsiyum perkloratın kaynama noktası
Ca(ClO4)2 kaynama noktasına ulaşmadan ayrıştığı için kaynama noktası yoktur. Isıtıldığında kalsiyum klorür, oksijen gazı ve klor gazına ayrışır. Bu ayrışma reaksiyonu güçlü bir şekilde ekzotermiktir ve önemli miktarda ısı açığa çıkar.
Kalsiyum perklorat Erime noktası
Ca(ClO4)2’nin erime noktası 200°C’dir. Bu sıcaklık katı Ca(ClO4)2’nin sıvı hale dönüştüğü noktadır. Erime noktası, Ca(ClO4)2’nin kurutma maddesi olarak kullanılabilme yeteneği gibi fiziksel özelliklerinin belirlenmesinde önemlidir.
Kalsiyum perklorat yoğunluğu g/mL
Ca(ClO4)2’nin yoğunluğu 2,505 g/mL’dir. Bu değer Ca(ClO4)2’nin birim hacmi başına kütle miktarını temsil eder. Ca(ClO4)2’nin yoğunluğu suyunkinden daha fazladır, yani suda batar.
Kalsiyum Perklorat Molekül Ağırlığı
Ca(ClO4)2’nin moleküler ağırlığı 238,98 g/mol’dür. Bu değer bir Ca(ClO4)2 molekülündeki tüm atomların atom ağırlıklarının toplamını temsil eder. Molekül ağırlığı, belirli bir reaksiyonda ihtiyaç duyulan Ca(ClO4)2 miktarının belirlenmesinde önemlidir.
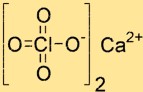
Kalsiyum perkloratın yapısı
Ca(ClO4)2’nin yapısı bir Ca2+ iyonu ve iki ClO4- iyonundan oluşur. Ca2+ iyonu yapının merkezinde yer alır ve iki ClO4- iyonundan kaynaklanan dört oksijen atomu ile çevrilidir. ClO4- iyonları tetrahedral şekillidir ve kalsiyum iyonuna oksijen atomları ile bağlanır.
Kalsiyum perkloratın çözünürlüğü
Ca(ClO4)2, 20°C’de 121 g/100 mL’lik bir çözünürlükle suda oldukça çözünür. Bu çözünürlük onu çevredeki suyu emebildiği için kurutma maddesi olarak faydalı kılar. Ancak etanol ve aseton gibi organik çözücülerde çözünmez.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 2,505 gr/ml |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 238,98 gr/mol |
| Yoğunluk | 2,505 gr/ml |
| Füzyon noktası | 200°C |
| Kaynama noktası | Kaynama noktasından önce ayrışır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 20°C’de 121 g/100 mL |
| çözünürlük | Organik çözücülerde çözünmez |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | Müsait değil |
| pH | Uygulanamaz |
Kalsiyum perkloratın güvenliği ve tehlikeleri
Ca(ClO4)2 çeşitli güvenlik riskleri taşır ve kullanılırken uygun güvenlik önlemleri alınmalıdır. Yanıcı maddelerle reaksiyona girerek yangına veya patlamaya neden olabilen güçlü bir oksidandır. Tozunun veya buharının solunması solunum yollarında tahrişe neden olabilir ve cilt ile teması tahrişe veya yanıklara neden olabilir. Yutulması halinde de zararlıdır, sindirim kanalında tahrişe veya korozyona neden olur. Ca(ClO4)2 ile çalışırken eldiven ve gözlük gibi yeterli kişisel koruyucu ekipman kullanılmalı ve yanıcı maddelerden ve uyumsuz maddelerden uzakta saklanmalıdır.
| Tehlike sembolleri | Oksitleyici madde, yutulması halinde zararlıdır |
| Güvenlik Açıklaması | Yanıcı maddelerden ve uyumsuz maddelerden uzak tutun. Eldiven ve koruyucu gözlük takın. Toz veya dumanları solumaktan kaçının. Temas halinde bol su ile yıkayın ve gerekiyorsa doktora başvurun. |
| BM kimlik numaraları | UN1502 |
| HS kodu | 2829.9000 |
| Tehlike sınıfı | 5.1 – Oksitleyici maddeler |
| Paketleme grubu | II |
| Toksisite | Yutulması halinde zararlıdır, cildi ve solunum sistemini tahriş eder |
Kalsiyum perklorat sentezi için yöntemler
Ca(ClO4)2, kalsiyum hidroksitin perklorik asit veya amonyum perkloratla reaksiyona sokulmasıyla sentezlenebilir.
Bir yöntem, kalsiyum karbonatın bir reaksiyon kabında perklorik asit ile reaksiyona sokulmasını, ardından katı ürünün elde edilmesi için çözeltinin filtrelenmesini ve buharlaştırılmasını içerir.
Başka bir yöntem, kalsiyum oksidin sulu bir perklorik asit çözeltisi ile reaksiyona sokulmasını, ardından elde edilen ürünün filtrelenmesini ve kurutulmasını içerir.
Bazı durumlarda Ca(ClO4)2, kalsiyum klorürün bir reaksiyon kabında sodyum perklorat ile reaksiyona sokulmasıyla sentezlenebilir. Reaksiyondan sonra Ca(ClO4)2 elde etmek için ürün filtrelenebilir ve kurutulabilir.
Ca(ClO4)2’yi sentezlemek için bir başka popüler yöntem, kalsiyum klorürün amonyum perkloratla reaksiyonunu içerir; bu, yan ürünler olarak Ca(ClO4)2 ve amonyum klorür üretir. Piroteknik uygulamalar, yüksek saflıkta Ca(ClO4)2 üretme kabiliyeti nedeniyle bu yöntemi tercih etmektedir.
Perklorik asitle çalışırken, organik malzemelerle reaksiyona girerek yangına veya patlamaya neden olabilecek güçlü bir oksitleyici madde olduğundan, uygun güvenlik önlemlerinin alınması gerektiğine dikkat etmek önemlidir.
Kalsiyum Perklorat Kullanım Alanları
Ca(ClO4)2’nin çeşitli endüstrilerde ve uygulamalarda çeşitli kullanımları vardır. Ca(ClO4)2’nin bazı kullanım alanları şunlardır:
- Piroteknik: Yüksek oksijen içeriği ve stabilitesi nedeniyle piroteknikte yaygın olarak oksitleyici bir madde olarak kullanılır.
- Gübre: Bitkilere büyümeleri için gerekli besin maddeleri olan kalsiyum ve kloru sağlamak için gübrelerde kullanılır.
- Roket Yakıtı: Yüksek oksijen içeriği ve kararlılığı nedeniyle roket yakıtının bir bileşeni olarak kullanılır.
- Petrol rafinasyonu: Petrol endüstrisinde ham petrolden ve diğer hidrokarbonlardan kükürt bileşiklerini çıkarmak için kullanılır.
- Hava Yastığı Şişiricileri: Çabuk parçalanıp gaz üretme özelliklerinden dolayı hava yastığı şişiricilerinin imalatında kullanılır.
- İşaret fişeği: Yüksek oksijen içeriği ve kararlılığı nedeniyle işaret fişeği imalatında kullanılır.
- Metal yüzey işlemi: Pas ve diğer yabancı maddeleri gidermek için metal yüzeylerin işlenmesinde kullanılır.
- Laboratuvar Uygulamaları: Perklorik asit hazırlanması ve kurutma maddesi olarak çeşitli laboratuvar uygulamalarında kullanılır.
Sorular:
S: Kalsiyum perkloratın formülü nedir?
C: Ca(ClO4)2.
S: Kalsiyum perklorat iyonik mi yoksa kovalent mi?
C: Ca(ClO4)2 iyonik bir bileşiktir çünkü kalsiyum katyonlarından (Ca2+) ve perklorat anyonlarından (ClO4-) oluşur.
S: Kalsiyum perklorat’ı nasıl imha edebilirim?
C: Ca(ClO4)2, etkilenen bölgeyi suyla yıkayarak ve ardından bileşiğin kalan izlerini sodyum bikarbonat gibi zayıf bir bazla nötrleştirerek çıkarılabilir.
S: Kalsiyum perklorat çözünür mü?
C: Evet, Ca(ClO4)2 suda ve diğer polar çözücülerde çözünür. Sudaki çözünürlüğü oda sıcaklığında 100 mL su başına yaklaşık 120 g’dır.
S: Kalsiyum perklorat ve su hangi reaksiyonlara neden olur?
C: Ca(ClO4)2 ve su normal şartlarda birbirleriyle reaksiyona girmez.
Soru: 0,650 mol Ca(ClO4)2’de kaç tane klor atomu vardır?
C: 0,650 mol Ca(ClO4)2’de 5,88 x 10^23 klor atomu vardır.
Soru: Ca(ClO4)2’nin molar kütlesi nedir?
A: Ca(ClO4)2’nin molar kütlesi 238,98 g/mol’dür.
Soru: 0,073 M HCl ve 0,0090 M Ca(ClO4)2 içeren bir çözeltide H’nin aktivite katsayısı nedir?
A: 0,073 M HCl ve 0,0090 M Ca(ClO4)2 içeren bir çözeltideki H’nin aktivite katsayısı sıcaklığa ve diğer faktörlere bağlıdır. Termodinamik modeller ve deneysel veriler kullanılarak hesaplanabilir.
Soru: 26,0 gram Ca(ClO4)2’de kaç mol vardır?
A: 26,0 gram bileşikte 0,109 mol Ca(ClO4)2 bulunmaktadır.
