Kalsiyum nitrit (Ca(NO2)2), betonda korozyon önleyici olarak yaygın olarak kullanılan kimyasal bir bileşiktir. Çelik donatıların korozyonunu önlemeye yardımcı olur.
| IUPAC’ın adı | Kalsiyum dinitrit |
| Moleküler formül | Ca(NO2)2 |
| CAS numarası | 13780-06-8 |
| Eş anlamlı | Kalsiyum nitrit dihidrat, nitröz asit, kalsiyum tuzu, nitrik asit, kalsiyum tuzu, dihidrat vb. |
| InChI | InChI=1S/Ca.2HNO2/c;2 2-1-3/h;2 (H,2,3) |
Kalsiyum nitritin özellikleri
Kalsiyum nitrit formülü
Kalsiyum nitritin kimyasal formülü Ca(NO2)2’dir. Bu formül, bileşiğin her kalsiyum katyonu için iki nitrit anyonu içerdiğini gösterir. Formül, bileşiğin bileşiminin belirlenmesinde ve bileşikteki her bir elementin miktarının belirlenmesinde önemlidir.
Kalsiyum Nitrit Molar Kütle
Kalsiyum dinitrit olarak da bilinen Ca(NO2)2’nin molar kütlesi yaklaşık 132,09 g/mol’dür. Kalsiyum katyonları ve nitrit anyonlarından oluşan iyonik bir bileşiktir. Molar kütle, bileşiği oluşturan elementlerin (bu durumda kalsiyum, nitrojen ve oksijendir) atomik kütlelerinin eklenmesiyle hesaplanır.
Kalsiyum nitritin kaynama noktası
Ca(NO2)2’nin kaynama noktası yaklaşık 400°C’dir (752°F). Bu yüksek kaynama noktası, bileşikteki Ca2+ ve NO2- iyonları arasında bulunan güçlü iyonik bağlardan kaynaklanmaktadır. Ca(NO2)2 ısıtıldığında termal bozunmaya uğrar ve nitrojen dioksit ve oksijen açığa çıkar.
Kalsiyum nitrit Erime noktası
Ca(NO2)2’nin erime noktası yaklaşık 132°C’dir (270°F). Bu erime noktası, erime noktası 801°C (1,474°F) olan sodyum klorür gibi diğer iyonik bileşiklerle karşılaştırıldığında nispeten düşüktür. Ca(NO2)2’nin düşük erime noktası, Ca2+ ve NO2- iyonları arasında bulunan nispeten zayıf iyonik bağlara bağlanabilir.
Kalsiyum nitritin yoğunluğu g/mL
Ca(NO2)2’nin yoğunluğu yaklaşık 2,32 g/mL’dir. Bu değer Ca(NO2)2’nin nispeten yoğun bir bileşik olduğunu gösterir. Yoğunluk, bileşiğin kütlesinin hacmine bölünmesiyle hesaplanır. Ca(NO2)2’nin yüksek yoğunluğu nispeten ağır kalsiyum katyonlarının varlığına bağlanabilir.
Kalsiyum Nitrit Molekül Ağırlığı
Ca(NO2)2’nin moleküler ağırlığı yaklaşık 132,09 g/mol’dür. Bu değer, bileşiği oluşturan elementlerin atom ağırlıklarının eklenmesiyle hesaplanır. Molekül ağırlığı, bileşiğin belirli sayıda molünü elde etmek için gereken Ca(NO2)2 miktarının belirlenmesinde önemlidir.
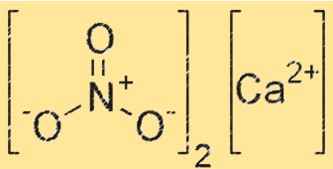
Kalsiyum nitritin yapısı
Ca(NO2)2’nin yapısı Ca2+ ve NO2-‘den oluşur. Ca2+ iyonları kristal kafesin merkezinde bulunurken, NO2- iyonları onları çevreler. Kristal kafes, Ca2+ ve NO2- iyonları arasındaki güçlü iyonik bağlarla bir arada tutulur.
Kalsiyum nitritin çözünürlüğü
Ca(NO2)2 su ve alkolde çözünür. Suda çözünürlüğü nispeten yüksektir; oda sıcaklığında yaklaşık 61 g/100 ml su çözünürlüğü vardır. Alkoldeki çözünürlüğü sudakinden daha düşüktür. Ca(NO2)2’nin çözünürlüğü, beton üretimi gibi çeşitli uygulamalardaki kullanımının belirlenmesinde önemlidir.
| Dış görünüş | Beyaz ila hafif sarı kristal toz veya katı |
| Spesifik yer çekimi | 2.32 |
| Renk | Renksizden beyaza |
| Koku | Kokusuz |
| Molar kütle | 132,09 gr/mol |
| Yoğunluk | 2,32 gr/ml |
| Füzyon noktası | 132°C (270°F) |
| Kaynama noktası | Yaklaşık 400°C’de (752°F) ayrışır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çözünür |
| çözünürlük | Su ve alkolde çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Doğal |
Kalsiyum Nitritin Güvenliği ve Tehlikeleri
Ca(NO2)2 yutulması, solunması veya cilt veya gözlerle teması halinde zararlı olabilir. Bu tahrişe, yanıklara ve solunum problemlerine neden olabilir. Bileşik aynı zamanda bir oksitleyici maddedir ve asitler ve metaller gibi diğer kimyasallarla reaksiyona girerek tehlikeli maddeler oluşturabilir. Ca(NO2)2 serin, kuru ve iyi havalandırılmış bir alanda, uyumsuz malzemelerden uzakta saklanmalıdır. Bileşik kullanılırken eldiven ve gözlük gibi kişisel koruyucu ekipmanlar giyilmelidir. Maruz kalınması durumunda derhal tıbbi yardıma başvurulmalı ve kirlenmiş giysiler çıkarılmalıdır.
| Tehlike sembolleri | Xn |
| Güvenlik Açıklaması | Cilt ve gözlerle temasından kaçının; kişisel koruyucu ekipman (KKD) kullanın; Maruz kalma durumunda derhal tıbbi yardıma başvurun. |
| BM kimlik numaraları | BM 1454 |
| HS kodu | 2834.29.90 |
| Tehlike sınıfı | 5.1 |
| Paketleme grubu | III |
| Toksisite | Yutulması veya solunması halinde zararlıdır; tahrişe, yanıklara ve solunum problemlerine neden olabilir |
Kalsiyum nitrit sentez yöntemleri
Nitrik asit veya nitrojen oksitlerin kalsiyum karbonat ile reaksiyonu, nitröz asit veya nitrojen oksitlerin karbon hidroksit ile reaksiyonu dahil olmak üzere Ca(NO2)2’yi çeşitli yöntemler sentezleyebilir. kalsiyum ve kalsiyum hidroksit veya amonyum hidroksitin kalsiyum nitratla reaksiyonu.
Yaygın bir yöntem, kalsiyum nitrat üretmek için kalsiyum karbonatın nitrik asitle reaksiyona sokulmasıdır. Daha sonra kalsiyum nitratın kalsiyum hidroksit ile reaksiyonu Ca(NO2)2 ve kalsiyum oksit yan ürünlerinin oluşumuyla sonuçlanır.
Diğer bir yöntem ise nitrojen oksitlerin kalsiyum hidroksit ile reaksiyona girerek Ca(NO2)2 ve kalsiyum nitrat üretmesini içerir.
Başka bir yöntemde, kalsiyum nitratı kalsiyum hidroksit veya amonyum hidroksit ile reaksiyona sokarak Ca(NO2)2 üretebilir ve bir yandan da yan ürün olarak kalsiyum nitrat üretebilirsiniz.
Kalsiyum Nitritin Kullanım Alanları
Ca(NO2)2’nin farklı endüstrilerde çeşitli uygulamaları vardır:
- Beton Sanayi: Beton yapıların dayanıklılığını ve mukavemetini arttırmak amacıyla betona katkı maddesi olarak kullanılır. Donatı çeliğini klorürlerin ve diğer agresif iyonların neden olduğu korozyondan koruyan bir korozyon önleyici görevi görür.
- Tarım: Bitkilere azot ve kalsiyum kaynağı sağlamak amacıyla tarımda gübre olarak kullanılır. Ayrıca toprak kalitesini iyileştirmek ve bitki büyümesini teşvik etmek için toprak düzenleyici olarak da kullanılır.
- Kimya endüstrisi: Kimyasal reaksiyonlarda indirgeyici madde olarak ve ayrıca kalsiyum nitrat ve kalsiyum amonyum nitrat gibi diğer kimyasalların sentezinde öncü olarak kullanılır.
- Atık Su Arıtma: Kirletici maddeleri uzaklaştırmak ve sudaki zararlı maddelerin konsantrasyonunu azaltmak için atık su arıtma kimyasalı olarak kullanılır.
- Gıda endüstrisi: Et, balık ve diğer gıda ürünlerinde bakteri ve diğer mikroorganizmaların büyümesini önlemek amacıyla gıda koruyucu olarak kullanılır.
Sorular:
S: Kalsiyum nitritin formülü nedir?
C: Kalsiyum nitritin kimyasal formülü Ca(NO2)2’dir.
S: Betonda her yıl ne kadar kalsiyum nitrit kullanılıyor?
C: Her yıl betonda kullanılan Ca(NO2)2 miktarı, spesifik uygulamaya ve pazar talebine bağlı olarak değişir. Ancak dünya çapında her yıl birkaç bin ton Ca(NO2)2’nin beton katkı maddesi olarak kullanıldığı tahmin edilmektedir.
Soru: Kalsiyum nitrit suda çözünür mü?
C: Evet, Ca(NO2)2 suda çözünür. 20°C’de yaklaşık 167 g/L çözünürlüğe sahiptir.
S: Kalsiyum nitrit bir tuz mudur?
C: Evet, Ca(NO2)2 tuzdur. Kalsiyum katyonları (Ca2+) ve nitrit anyonlarından (NO2-) oluşan iyonik bir bileşik.
S: Aşağıdaki çözümler nasıl hazırlanır? 1,25 l 0,775 m Ca(NO2)2 çözeltisi
C: 1,25 L’lik 0,775 M’lik Ca(NO2)2 çözeltisi hazırlamak için, yaklaşık 187,5 g Ca(NO2)2’yi, 1,25 L’lik nihai hacim elde etmeye yetecek kadar suda çözmeniz gerekir. Bu, şu formül kullanılarak hesaplanabilir: formül formül: çözünen maddenin gramı = Molarite x hacim (litre cinsinden) x çözünen maddenin molar kütlesi.
S: Kalsiyum nitritin iyonik bileşik formülü nedir?
A: Ca(NO2)2’nin iyonik bileşik formülü Ca(NO2)2’dir. Bir kalsiyum iyonu (Ca2+) ve iki nitrit iyonundan (NO2-) oluşur.
