Kalsiyum klorat (Ca(ClO3)2), kalsiyum, klor ve oksijenden oluşan kimyasal bir bileşiktir. Havai fişeklerde ve kibritlerde oksitleyici bir madde olarak yaygın olarak kullanılır. Ayrıca gıda endüstrisindeki ekipmanların sterilizasyonunda da kullanılabilir.
| IUPAC Adı | Kalsiyum klorat |
| Moleküler formül | Ca(ClO3)2 |
| CAS numarası | 10137-74-3 |
| Eş anlamlı | Klorik asit, kalsiyum tuzu; Hidratlı kalsiyum klorat; Kalsiyum perklorat; Kalsiklorit; UN1456 |
| InChI | InChI=1S/Ca.2ClH03/c;2 2-1(3)4/h;2 (H,2,3,4)/q+2;;/p-2 |
Kalsiyum kloratın özellikleri
Kalsiyum Klorat Formülü
Kalsiyum kloratın formülü Ca(ClO3)2’dir. Bir Ca2+ iyonu ve iki ClO3- iyonundan oluşur. Kalsiyum klorat iyonik bir bileşiktir, yani pozitif ve negatif iyonlar arasındaki elektrostatik çekimle bir arada tutulur.
Kalsiyum Klorat Molar Kütlesi
Ca(ClO3)2’nin molar kütlesi 206,98 g/mol’dür. Bu, bileşiği oluşturan kalsiyum, klor ve oksijenin atomik kütleleri eklenerek hesaplanabilir. Molar kütle, belirli bir reaksiyon için gerekli olan Ca(ClO3)2 miktarının hesaplanmasında önemlidir.
Kalsiyum kloratın kaynama noktası
Ca(ClO3)2 kaynama noktasına ulaşmadan ayrıştığı için kaynama noktası yoktur. Ca(ClO3)2 ısıtıldığında kalsiyum klorüre (CaCl2) ve oksijen gazına (O2) ayrışır. Bu ayrışma ekzotermiktir ve uygun şekilde ele alınmazsa tehlikeli olabilir.
Kalsiyum klorat Erime noktası
Ca(ClO3)2’nin erime noktası 135°C’dir. Bu, katı bileşiğin katıdan sıvıya dönüştüğü sıcaklıktır. Ca(ClO3)2 oda sıcaklığında ve basınçta beyaz kristal bir katıdır.
Kalsiyum kloratın yoğunluğu g/mL
Ca(ClO3)2’nin yoğunluğu 2,4 g/mL’dir. Bu, bir mililitre Ca(ClO3)2’nin 2,4 gram ağırlığında olduğu anlamına gelir. Yoğunluk, bir maddedeki moleküllerin yoğunluğunun bir ölçüsüdür. Ca(ClO3)2, yoğunluğu 1 g/mL olan sudan daha yoğundur.
Kalsiyum Klorat Molekül Ağırlığı
Ca(ClO3)2’nin moleküler ağırlığı 206,98 g/mol’dür. Molar kütle ile aynıdır ve bileşikteki bireysel elementlerin atom ağırlıkları toplanarak hesaplanabilir.
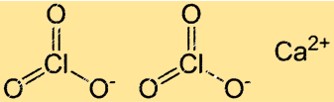
Kalsiyum kloratın yapısı
Ca(ClO3)2, iyonik bileşiklere özgü bir kristal kafes yapısına sahiptir. Bu yapıda Ca2+ ve ClO3- iyonları düzenli ve tekrarlanan bir düzende düzenlenmiştir. Her Ca2+ iyonu altı ClO3- iyonuyla, her klorat iyonu ise altı kalsiyum iyonuyla çevrilidir.
Kalsiyum kloratın çözünürlüğü
Ca(ClO3)2 suda çözünür ve berrak, renksiz bir çözelti oluşturur. Ca(ClO3)2’nin sudaki çözünürlüğü sıcaklıkla artar. Ancak etanol ve aseton gibi organik çözücülerde daha az çözünür. Ca(ClO3)2 de higroskopiktir, yani havadaki nemi emer. Bu, bileşiğin zamanla ıslanmasına veya çözünmesine neden olabilir.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 2.4 |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 206,98 gr/mol |
| Yoğunluk | 2,4g/ml |
| Füzyon noktası | 135°C |
| Kaynama noktası | Kaynama noktasından önce ayrışır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çözünür |
| çözünürlük | Suda çözünür, organik çözücülerde daha az çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Uygulanamaz |
Kalsiyum kloratın güvenliği ve tehlikeleri
Ca(ClO3)2 tehlikeli bir madde olarak kabul edilir ve dikkatle kullanılmalıdır. Organik maddelerle şiddetli reaksiyona girerek yangınlara ve patlamalara neden olabilen oksitleyici bir maddedir. Ca(ClO3)2’nin solunması veya yutulması solunum ve mide-bağırsak tahrişine neden olabilir. Uzun süreli maruz kalma cilt tahrişine, yanıklara ve olası alerjik reaksiyonlara neden olabilir. Ca(ClO3)2 ile çalışırken eldiven, gözlük ve solunum cihazı dahil uygun kişisel koruyucu ekipmanın kullanılması önemlidir. Maruz kalma durumunda derhal tıbbi yardıma başvurun. Ca(ClO3)2’yi serin, kuru ve iyi havalandırılan, uyumsuz maddelerden uzak bir yerde saklayın.
| Tehlike sembolleri | O, Xn |
| Güvenlik Açıklaması | Organik malzemelerden uzak tutun. Kişisel koruyucu ekipman giyin. Serin, kuru ve iyi havalandırılmış bir yerde saklayın. |
| BM kimlik numaraları | UN1458 |
| HS kodu | 2829.11.00 |
| Tehlike sınıfı | 5.1 |
| Paketleme grubu | II |
| Toksisite | Yutulması veya solunması halinde toksiktir. Cilt ve göz tahrişine neden olabilir. Solunum yolu tahrişine neden olabilir. |
Kalsiyum klorat sentez yöntemleri
Ca(ClO3)2’yi sentezlemek için farklı yöntemler kullanabiliriz.
Yaygın bir yöntem, kalsiyum hidroksitin klor gazı ile reaksiyonunu içerir. Bu işlemde ilk olarak yan ürün olarak kalsiyum klorür oluşur ve bu, geri kalan klorla reaksiyona girerek Ca(ClO3)2 oluşturur.
Başka bir yöntem, kalsiyum karbonatın nitrik asit ve klor gazı ile reaksiyonunu içerir. Ca(ClO3)2 elde etmek için elde edilen çözelti buharlaştırılır ve kristalleştirilir.
Başka bir yaklaşım, kalsiyum klorür ve sodyum klorat içeren bir çözeltinin elektrolizini içerir. Bu işlem son ürünler olarak Ca(ClO3)2 ve sodyum klorürü verir.
Kalsiyum hipoklorit ve sodyum klorat arasındaki reaksiyon Ca(ClO3)2’yi üretir ve bu daha sonra saflaştırılıp kristalleştirilir.
Kalsiyum Kloratın Kullanım Alanları
Ca(ClO3)2’nin çeşitli endüstrilerde birçok önemli kullanımı vardır. Ca(ClO3)2’nin en yaygın uygulamalarından bazıları şunlardır:
- Ağartıcı: Kağıt hamuru ve kağıt endüstrisinde ağartma maddesi olarak kullanılır.
- Havai fişek: Havai fişek üretiminde yaygın olarak kullanılan oksitleyici bir madde.
- Kibritler: Kolayca tutuşabildikleri için emniyet kibritlerinin üretiminde de kullanılır.
- Herbisitler: Herbisit olarak kullanılır çünkü mahsullere zarar vermeden belirli yabani otları seçici olarak öldürebilir.
- Oksitleyici madde: Perkloratlar ve kloratlar gibi diğer kimyasalların üretiminde oksitleyici madde olarak kullanılır.
- İlaçlar: Anti-enfektif ilaçlar gibi farmasötik ürünlerin üretiminde de kullanılır.
- Laboratuvar reaktifi: analitik kimya için laboratuvar reaktifi olarak kullanılır.
- Pigment Üretimi: Lacivert gibi pigmentlerin üretiminde kullanılır.
Sorular:
S: Kalsiyum kloratın formülü nedir?
C: Kalsiyum kloratın kimyasal formülü Ca(ClO3)2’dir.
S: Kalsiyum klorat ne için kullanılır?
C: Ca(ClO3)2’nin kağıt hamuru ve kağıt endüstrisinde ağartma maddesi, diğer kimyasalların üretiminde oksitleyici madde, herbisit, üretim pigmentleri ve laboratuvar reaktifleri gibi endüstrilerde çeşitli uygulamaları vardır.
S: Kalsiyum klorat katı mıdır?
C: Evet, Ca(ClO3)2 oda sıcaklığında katıdır.
S: Sodyum klorat en yaygın olarak nerede bulunur ve kalsiyum klorat ne için kullanılır?
C: Sodyum klorat en yaygın olarak kimya endüstrisinde oksitleyici bir madde ve herbisit olarak kullanılır. Ca(ClO3)2 ise çeşitli endüstrilerde ağartma maddesi, oksitleyici madde ve herbisit olarak kullanılmaktadır.
Soru: Ca(ClO3)2 bileşiğindeki toplam atom sayısı nedir?
C: Ca(ClO3)2 bileşiğinin toplam 13 atomu vardır: 1 kalsiyum atomu, 2 klor atomu ve iki ClO3- iyonundan 6 oksijen atomu.
Soru: Ca(ClO3)2’deki klorun kütle yüzdesi nedir?
A: Klorun atom kütlesi 35,5 g/mol ve Ca(ClO3)2’nin molar kütlesi 238,98 g/mol’dür. Bu nedenle Ca(ClO3)2’deki klorun kütle yüzdesi (2 x 35,5 g/mol) / 238,98 g/mol x %100 = %29,68’dir.
Soru: Ca(ClO3)2’de kaç tane klor atomu vardır?
C: Ca(ClO3)2’de iki ClO3 grubuyla temsil edilen iki klor atomu vardır.
S: Orijinal Ca(ClO3)2 ve Ca(ClO)2 karışımındaki her bir bileşiğin kütlesi nedir?
C: Orijinal karışımdaki her bileşiğin kütlesini, toplam kütle veya iki bileşik arasındaki kütle oranı gibi ek bilgiler olmadan belirlemek imkansızdır.
