Kalsiyum karbür, CaC2 formülüne sahip kimyasal bir bileşiktir. Esas olarak asetilen gazı ve kalsiyum siyanamid üretmek için kullanılır. Asetilen gazı ve kalsiyum hidroksit üretmek için suyla reaksiyona girer. İnsanlar bunu kaynak ve aydınlatma için kullanıyor.
| IUPAC’ın adı | Kalsiyum etinediit |
| Moleküler formül | CaC2 |
| CAS numarası | 75-20-7 |
| Eş anlamlı | Kalsiyum asetilit, kalsiyum perkarbon, kalsiyum dikarbit, kalsiyum karbüro, karbür kalsiko, kalsiyum etinediit |
| InChI | InChI=1S/C2.Ca/c1-2;/q-2;+2 |
Kalsiyum karbürün özellikleri
Kalsiyum Karbür Formülü
Kalsiyum karbürün kimyasal formülü CaC2’dir. Bu, bir kalsiyum karbür molekülünün bir kalsiyum atomu ve iki karbon atomundan oluştuğu anlamına gelir. Formül, bileşiğin elementlerinin oranını gösterir.
Kalsiyum Karbür Molar Kütle
CaC2’nin molar kütlesi 64.099 g/mol’dür. Bu, bir mol CaC2’nin kütlesinin 64.099 gram olduğu anlamına gelir. Molar kütle, formüldeki elementlerin atomik kütlelerinin eklenmesiyle hesaplanır. Kalsiyumun atom kütlesi 40.078 g/mol, karbonunki ise 12.011 g/mol’dür.
Kalsiyum karbürün kaynama noktası
CaC2’nin kaynama noktası 2300°C’dir. Bu, CaC2’nin bu sıcaklıkta sıvıdan gaza dönüştüğü anlamına gelir. Kaynama noktası moleküller arası kuvvetlerden ve atmosfer basıncından etkilenir. CaC2, kırılması için çok fazla enerji gerektiren güçlü iyonik bağlara sahiptir.
Kalsiyum karbür Erime noktası
CaC2’nin erime noktası 2160°C’dir. Bu, CaC2’nin bu sıcaklıkta katıdan sıvıya dönüştüğü anlamına gelir. Erime noktası aynı zamanda moleküller arası kuvvetlerden ve atmosfer basıncından da etkilenir. CaC2, güçlü iyonik bağlarından dolayı yüksek bir erime noktasına sahiptir.
Kalsiyum karbür yoğunluğu g/ml
CaC2’nin yoğunluğu 2,22 g/ml’dir. Bu, bir mililitre CaC2’nin kütlesinin 2,22 gram olduğu anlamına gelir. Yoğunluk, kütlenin hacme bölünmesiyle hesaplanır. Yoğunluk, maddedeki atomların veya moleküllerin konfigürasyonuna ve düzenine bağlıdır. CaC2 yüksek bir yoğunluğa sahiptir çünkü atomları bir kristal yapıda birbirine sıkı bir şekilde paketlenmiştir.
Kalsiyum Karbür Molekül Ağırlığı
CaC2’nin moleküler ağırlığı 64.099 amu’dur (atomik kütle birimi). Bu, bir CaC2 molekülünün 64.099 amu’luk bir kütleye sahip olduğu anlamına gelir. Molekül ağırlığı, formüldeki elementlerin atom kütlelerinin ilgili atom sayılarıyla çarpılmasıyla hesaplanır. Kalsiyumun atom kütlesi 40.078 amu ve karbonunki 12.011 amu’dur.
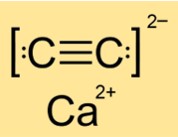
Kalsiyum karbür yapısı
CaC2’nin yapısı faza (I, II veya III) bağlı olarak tetragonal, monoklinik veya monokliniktir. Bu, CaC2’nin farklı durum ve koşullarda atomlarının veya moleküllerinin farklı şekil ve düzenlemelerine sahip olduğu anlamına gelir. Yapı, maddenin simetrisi ve geometrisi tarafından belirlenir. CaC2, faz I’de tetragonal bir yapıya, faz II’de monoklinik bir yapıya ve faz III’te başka bir monoklinik yapıya sahiptir.
Kalsiyum karbürün çözünürlüğü
CaC2’nin çözünürlüğü suda hızlı hidrolizdir. Bu, CaC2’nin suyla hızla reaksiyona girdiği ve ürünler olarak asetilen gazı ve kalsiyum hidroksit oluşturduğu anlamına gelir. Çözünürlük, belirli bir sıcaklık ve basınçta, belirli bir çözücü içinde çözünebilen madde miktarıyla ölçülür. Çözünürlük, maddenin ve çözücünün doğasına ve polaritesine ve ayrıca pH ve tuzluluk gibi diğer faktörlere bağlıdır.
| Dış görünüş | Gri/siyah kristalli veya renksiz kristal katı içeren beyaz toz 3 |
| Spesifik yoğunluk | 2.22 |
| Renk | Renksiz (saf) veya gri/kahverengi (teknik kalite) |
| Koku | Kokusuz (saf) veya sarımsak benzeri (teknik dereceli) |
| Molar kütle | 64.099 gr/mol |
| Yoğunluk | 2,22 gr/cm3 |
| Füzyon noktası | 2160°C |
| Kaynama noktası | 2300°C |
| Flaş noktası | 305°C (asetilen) |
| sudaki çözünürlük | Hızlı hidroliz |
| çözünürlük | Etanol ve eterde çözünmez |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | 2.21 (asetilen) |
| pKa | Uygulanamaz |
| pH | Uygulanamaz |
Kalsiyum Karbürün Güvenliği ve Tehlikeleri
CaC2 yanıcı ve tehlikeli bir kimyasaldır. Su veya nem ile teması halinde yangın ve patlama tehlikesi oluşturabilir. Aynı zamanda yanıcı ve patlayıcı olan asetilen gazı açığa çıkarır. CaC2 sağlığınıza da zarar verebilir. Bu cildi, gözleri ve akciğerleri tahriş edebilir. Bu, döküntüye, göz hasarına, öksürüğe ve nefes darlığına neden olabilir. Ayrıca, büyük miktarda nefes almanız durumunda ciğerlerinizde sıvı birikmesine de neden olabilir. CaC2 ile temastan kaçınmalı ve kullanırken koruyucu ekipman kullanmalısınız. Ayrıca kuru, kapalı bir kapta, herhangi bir tutuşma kaynağından uzakta saklamalısınız.
| Tehlike sembolleri | F (çok yanıcı), C (aşındırıcı), W (su ile reaksiyona girer) |
| Güvenlik Açıklaması | S2 (çocukların ulaşamayacağı yerde saklayın), S7/8 (kabı sıkıca kapalı ve kuru tutun), S16 (tutuşturucu kaynaklardan uzak tutun), S26 (gözle teması halinde derhal bol su ile yıkayın ve doktora başvurun) tavsiye), S36/37/39 (uygun koruyucu kıyafet, eldiven ve göz/yüz koruyucu kullanın), S43 (yangın durumunda kuru kum veya kuru kimyasal toz kullanın), S45 (kaza veya rahatsızlık durumunda, derhal tıbbi tavsiye) |
| BM kimlik numaraları | BM 1402 |
| HS kodu | 28491000 |
| Tehlike sınıfı | 4.3 |
| Paketleme grubu | BEN |
| Toksisite | Oral LD50 sıçan: 80 mg/kg, LC50 soluma sıçanı: 1000 ppm/4 saat |
Kalsiyum Karbür Sentez Yöntemleri
CaC2’yi kalsiyum ve karbon oksit kaynaklarından sentezlemek için farklı yöntemler vardır.
En yaygın yöntemlerden biri elektrik ark ocağı yöntemidir. Bu süreçte, bir elektrik arkı kireç ve kok karışımını yaklaşık 2.200°C’ye ısıtır. Reaksiyon endotermiktir ve erimiş CaC2 ve karbon monoksit üretir. CaC2 eritildikten sonra soğur ve kullanım amacına göre öğütülerek parçalara veya toz haline getirilir. Bu yöntemin enerji tüketimi ve ekipman maliyeti yüksektir.
Diğer bir yöntem ise katı hal yöntemidir. Bu yöntemi gerçekleştirmek için, kalsiyum oksit ve biyokömür veya biyokütleden türetilmiş odun kömürü karışımını bir fırında yaklaşık 1.750°C’ye ısıtın. Reaksiyon katı-katıdır ve katı CaC2 ve karbon monoksit üretir. CaC2 katısını doğrudan kullanabilir veya daha fazla işleyebilirsiniz. Bu yöntemin enerji tüketimi ve ekipman maliyeti elektrik ark ocağı yöntemine göre daha düşüktür.
Üçüncü bir yöntem ise kömür kok güç kalitesi ikame yöntemidir. İşlemi gerçekleştirmek için düşük kaliteli kömür ve kireç karıştırılarak peletler oluşturulur ve ardından 1000°C sıcaklıktaki fırında piroliz edilir. Üretilen gaz elektrik üretiyor ve sıcak peletler 2000°C’deki CaC2 fırınına aktarılıyor. Reaksiyon katı-katıdır ve erimiş CaC2 ve karbon monoksit üretir. Soğutulduktan sonra erimiş CaC2, topaklar veya toz oluşturmak üzere öğütülmeye tabi tutulur. Bu yöntem, elektrik ark ocağı yöntemine göre daha yüksek enerji verimliliğine ve kaynak kullanımına sahiptir.
Kalsiyum Karbürün Kullanım Alanları
- CaC2 su ile reaksiyona girdiğinde asetilen gazı ve kalsiyum hidroksit üretir. Asetilen gazı, polivinil klorür, vinil asetat, 1,4-butandiol vb. gibi birçok organik kimyasalın ve polimerin sentezi için önemli bir ara maddedir. Kalsiyum hidroksit, birden fazla kullanıma sahip çok yönlü bir bileşiktir.
- Kalsiyum siyanamid üretmek için insanlar CaC2’yi yüksek sıcaklıklarda nitrojenle reaksiyona sokar. Kalsiyum siyanamid azotlu gübre, herbisit ve yaprak dökücü görevi görür.
- Demir, dökme demir, dökme demir ve çeliğin kükürt içeriğini azaltmak için CaC2 kullanılır. Bu kimyasal bileşik kükürt ile reaksiyona girerek kalsiyum sülfür oluşturur ve metalin kükürtten arındırılmasını etkili bir şekilde sağlar. Bu işlem çelik ürünlerin kalitesini ve sünekliğini artırır.
- Karbür lambalar, yandığında ışık üreten asetilen gazı üretmek için CaC2 kullanır. Bu lambalar, elektrik lambaları yaygınlaşmadan önce madencilik, mağaracılık, bisiklet ve otomobil endüstrilerinde popülerdi.
- İnsanlar CaC2’yi muz, mango ve papaya gibi meyvelerde olgunlaştırıcı madde olarak kullanıyor. Etilen gazı salgılayarak olgunlaşma sürecini hızlandırır ve meyvenin rengini ve tatlılığını artırır. Pek çok ülke, meyveleri olgunlaştırmak için CaC2 kalıntısı kullanma uygulamasını, bununla ilişkili sağlık riskleri nedeniyle yasa dışı ve zararlı olarak değerlendirmektedir.
- İnsanlar yüksek ses çıkarmak için bambu toplarında ve büyük patlama toplarında CaC2 kullanıyorlar. Suyla karıştırıldığında herkes için eğlenceli ve şenlikli bir deneyim yaratmak üzere ateşlenen asetilen gazı üretir.
- Ayrıca çelik yapımında deoksidan olarak da kullanılır. Erimiş çelikten oksijeni uzaklaştırır ve çelik ürünlerin kalitesini etkileyebilecek oksitlerin oluşumunu engeller.
Sorular:
S: Kalsiyum karbür yerel olarak nereden satın alınır?
C: Bölgenizdeki bazı hırdavat veya kaynak malzemeleri mağazalarında az miktarda CaC2 bulabilirsiniz. Ancak büyük miktarlarda CaC2’ye ihtiyacınız varsa bunu doğrudan üreticilerden ithal etmek en iyisi olabilir. Bazı tedarikçilerle çevrimiçi iletişime geçebilirsiniz.
S: Kalsiyum karbür nasıl giderilir?
C: CaC2 tehlikeli bir atıktır ve uygun şekilde bertaraf edilmesi gerekir. Suyla reaksiyona girip yanıcı ve patlayıcı asetilen gazı üretebileceği için çöpe atmayın veya kanalizasyona atmayın. CaC2’nin güvenli bir şekilde nasıl imha edileceği konusunda tavsiye almak için yerel tehlikeli atık yetkilinizle veya lisanslı bir atık imha şirketiyle iletişime geçmelisiniz. İyi havalandırılmış bir alanda su ile nötralize edilmesi ve daha sonra nakliye için kapalı bir kapta paketlenmesi gerekebilir.
S: Kalsiyum karbür ağır su ile reaksiyona girdiğinde ne oluşur?
C: Ağır su, hidrojen yerine döteryum içeren sudur. Döteryum, çekirdeğinde bir proton ve bir nötron bulunan bir hidrojen izotopudur. CaC2 ağır suyla reaksiyona girdiğinde kalsiyum hidroksit ve döteryumlanmış asetilen oluşturur. Döteryumlanmış asetilen, hidrojen yerine döteryum içeren asetilendir. Bu reaksiyonun kimyasal denklemi şöyledir:
CaC2 + 2D2O -> Ca(OD)2 + C2D2
S: Kalsiyum karbür tehlikeli midir?
C: Evet, CaC2 tehlikelidir ve dikkatle kullanılmalıdır. Aynı zamanda yanıcı ve patlayıcı olan asetilen gazını açığa çıkardığı için su veya nem ile temas ettiğinde yangın ve patlama tehlikesi oluşturabilir. Cildinizi, gözlerinizi ve ciğerlerinizi tahriş edebileceği için sağlığınıza da zarar verebilir. CaC2 deri döküntülerine, göz hasarına, öksürüğe ve nefes darlığına neden olabilir. Ayrıca, büyük miktarda nefes almanız durumunda ciğerlerinizde sıvı birikmesine de neden olabilir. CaC2 ile temastan kaçınmalı ve kullanırken koruyucu ekipman kullanmalısınız. Ayrıca kuru, kapalı bir kapta, herhangi bir tutuşma kaynağından uzakta saklamalısınız.
S: Kalsiyum karbür iyonik mi yoksa kovalent mi?
C: CaC2 iyonik bir bileşiktir. Kalsiyum iyonlarından (Ca2+) ve karbür iyonlarından (C22-) oluşur. İyonik bileşikler, kararlı elektronik konfigürasyonlar elde etmek için metal atomları elektron kaybettiğinde ve ametal atomlar elektron kazandığında oluşur. Ortaya çıkan iyonlar elektrostatik çekim kuvvetleri tarafından bir arada tutulur. CaC2, kırılması için çok fazla enerji gerektiren güçlü iyonik bağlara sahiptir.
S: Kalsiyum karbür nasıl yapılır?
C: CaC2, kireç (kalsiyum oksit) ve kok (karbon) karışımının bir elektrik ark ocağında yaklaşık 2200°C’ye ısıtılmasıyla elde edilir. Reaksiyon endotermiktir ve erimiş CaC2 ve karbon monoksit üretir. Erimiş CaC2 daha sonra soğutulur ve parçalar veya toz halinde öğütülür. Bu yöntemin enerji tüketimi ve ekipman maliyeti yüksektir. Biyokömür veya düşük dereceli kömür gibi farklı karbon kaynaklarını kullanan başka yöntemler ve katı hal ısıtma veya indüksiyonla ısıtma gibi farklı ısıtma yöntemleri de vardır. Bu yöntemler, elektrik ark ocağı yöntemine göre daha düşük enerji tüketimine ve ekipman maliyetine sahip olabilir.
S: Kalsiyum karbonatı kalsiyum karbüre dönüştürebilir miyim?
C: Hayır, kalsiyum karbonatı doğrudan CaC2’ye dönüştüremezsiniz. Kalsiyum karbonat, yüksek sıcaklıklarda karbonla reaksiyona girmeyen stabil bir bileşiktir. Kalsiyum karbonatın öncelikle hava yokluğunda kuvvetli bir şekilde ısıtılarak (kalsinasyon) kalsiyum okside dönüştürülmesi gerekir. Daha sonra CaC2 (karbürizasyon) üretmek için kalsiyum oksidi yüksek sıcaklıklarda karbonla reaksiyona sokabilirsiniz. Bu prosesin genel kimyasal denklemi şöyledir:
CaCO3 -> CaO + CO2
CaO + 3C -> CaC2 + CO
Soru: Aşağıdaki tepkimelerden hangisi doğrudur? Ca(lar) + 2C(ler) -> CaC2(ler) + 62,8 kJ
C: Tepkime için aşağıdaki ifadeler doğrudur:
- İki veya daha fazla elementin birleşerek bir bileşik oluşturduğu sentetik bir reaksiyondur.
- Bu, ısının çevreye salındığı ekzotermik bir reaksiyondur.
- Bu, kalsiyumun oksitlendiği ve karbonun indirgendiği bir redoks reaksiyonudur.
- Bu, kalsiyum oksit ve karbondan CaC2 oluşumunun ters reaksiyonudur.
S: Cac2(ler)’in standart oluşum ısısı nedir?
C: Cac2(s)’nin standart oluşum ısısı, 25°C ve 1 atm’de standart hallerindeki elementlerinden bir mol CaC2 oluştuğunda meydana gelen entalpi değişimidir. Hess yasasını kullanarak verilen termokimyasal denklemlerden hesaplanabilir. CaC2 oluşumunun genel denklemi şöyledir:
Ca(lar) + 2C(ler) -> CaC2(ler)
Hess yasasını kullanarak şunu yazabiliriz:
ΔHf°(CaC2) = ΔH°(Ca + 2C -> CaC2)
= ΔH°(Ca + 2H2O -> Ca(OH)2 + H2) + ΔH°(Ca(OH)2 -> CaO + H2O) + ΔH°(CaO + 3C -> CaC2 + CO) + ΔH°(CO) -> C + O2) + ΔH°(H2 + O2 -> H2O)
= -414,79 kJ + 65,19 kJ + 462,30 kJ – 221,00 kJ – 571,80 kJ = -680,10 kJ
Bu nedenle cac2(s)’nin standart oluşum ısısı -680,10 kJ/mol’dür.
S: 0,35 mol hcch(g) üretmek için kaç gram cac2 gerekli olacaktır?
C: Bu soruyu cevaplamak için CaC2 ile su arasındaki reaksiyonun dengeli denklemini kullanmamız gerekiyor:
CaC2(ler) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
Bu denklemden, bir mol cac2’nin bir mol hcch (asetilen olarak da bilinir) ürettiğini görebiliriz. Bu nedenle 0,35 mol hcch üretmek için 0,35 mol cac2’ye ihtiyacımız var. Molleri gramlara dönüştürmek için cac2’nin molar kütlesi olan 64.099 g/mol’ü kullanmamız gerekir. Molleri molar kütle ile çarparak şunu elde ederiz:
0,35 mol x 64,099 g/mol = 22,435 g
Bu nedenle 0,35 mol hcch üretmek için 22,435 gram cac2’ye ihtiyacımız var.
S: 49,0 g su ile tamamen reaksiyona girebilmek için kaç mol cac2 gereklidir?
C: Bu soruyu cevaplamak için kalsiyum karbür ile su arasındaki reaksiyona ilişkin dengeli denklemi kullanmamız gerekir:
CaC2(ler) + 2H2O(l) -> C2H2(g) + Ca(OH)2(aq)
Bu denklemden bir mol cac2’nin iki mol h2o ile reaksiyona girdiğini görebiliriz. Bu nedenle, gereken cac2 mollerini bulmak için h2o mollerini ikiye bölmemiz gerekir. Gramı mol’e dönüştürmek için suyun molar kütlesi olan 18.015 g/mol’ü kullanmamız gerekir. Gramı molar kütleye bölerek şunu elde ederiz:
49,0 g / 18,015 g/mol = 2,72 mol
Bunu ikiye bölmek şunu verir:
2,72 mol / 2 = 1,36 mol
Bu nedenle 49,0 g h2o ile tamamen reaksiyona girebilmesi için 1,36 mol cac2’ye ihtiyacımız var.
S: Kalsiyum karbür ile su arasındaki reaksiyonun ürünleri nelerdir?
C: CaC2 ile su arasındaki reaksiyonun ürünleri asetilen gazı ve kalsiyum hidroksit çözeltisidir.
