Kalsiyum hipoklorit (Ca(ClO)2), dezenfektan ve ağartıcı olarak yaygın olarak kullanılan kimyasal bir bileşiktir. Su arıtma ve sanitasyonda bakteri, virüs ve alglerin öldürülmesinde etkilidir.
| IUPAC Adı | Kalsiyum hipoklorit |
| Moleküler formül | Ca(ClO)2 |
| CAS numarası | 7778-54-3 |
| Eş anlamlı | Hipokloröz asidin kalsiyum tuzu, Ağartma tozu, Klorlu kireç, Kalsiyum oksiklorür, HTH, Cal hipo |
| InChI | InChI=1S/Ca.2ClO/c;2 1-2/q+2;2 -1 |
Kalsiyum hipokloritin özellikleri
Kalsiyum Hipoklorit Formülü
Kalsiyum hipokloritin kimyasal formülü Ca(ClO)2’dir. Güçlü bir klor kokusu veren beyaz kristal bir katıdır. Kalsiyum hipokloritin formülü, bir Ca+2 iyonu ve iki ClO- iyonu içerdiğini gösterir. Hipoklorit iyonu negatif yüke sahiptir ve bileşiğin güçlü oksitleyici özelliklerinden sorumludur.
Kalsiyum Hipoklorit Molar Kütle
Ca(ClO)2’nin molar kütlesi 142,98 g/mol’dür. Bir Ca(ClO)2 molekülünde bulunan kalsiyum, klor ve oksijenin atomik kütlelerinin eklenmesiyle hesaplanır. Ca(ClO)2’nin molar kütlesi, çeşitli kimyasal hesaplamalarda kullanılan önemli bir parametredir.
Kalsiyum hipokloritin kaynama noktası
Ca(ClO)2 kaynama noktasına ulaşamadan ayrışır. Bu nedenle kaynama noktası iyi tanımlanmamıştır. Ca(ClO)2 ısıtıldığında termal bozunmaya uğrayarak kalsiyum klorür, oksijen ve klor gazı oluşturur.
Kalsiyum hipoklorit Erime noktası
Ca(ClO)2’nin erime noktası 100°C’dir. Bu sıcaklıkta Ca(ClO)2 eriyerek berrak bir sıvı oluşturur. Ca(ClO)2 suda çok çözünür ve suda çözündüğünde hipoklorit iyonları açığa çıkarır, bu da onu etkili bir dezenfektan yapar.
Kalsiyum hipokloritin yoğunluğu g/mL
Ca(ClO)2’nin yoğunluğu 2,35 g/mL’dir. Nispeten yoğun bir bileşiktir ve sudan daha ağırdır. Ca(ClO)2’nin yüksek yoğunluğu, kristal kafesindeki kalsiyum iyonlarının varlığından kaynaklanmaktadır.
Kalsiyum Hipoklorit Molekül Ağırlığı
Ca(ClO)2’nin moleküler ağırlığı 142,98 g/mol’dür. Bir Ca(ClO)2 molekülünde bulunan kalsiyum, klor ve oksijenin atomik kütlelerinin eklenmesiyle hesaplanır. Ca(ClO)2’nin moleküler ağırlığı, çeşitli kimyasal hesaplamalarda kullanılan önemli bir parametredir.
Kalsiyum hipokloritin yapısı
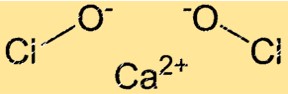
Ca(ClO)2 kristal yapıya sahiptir. Ca(ClO)2 kristal kafesi Ca+2 iyonları ve ClO- iyonlarından oluşur. ClO- iyonları, Ca+2 iyonlarının etrafında tetrahedral bir geometride düzenlenmiştir. Ca(ClO)2’nin kristal kafes yapısı ona güçlü oksitleyici özellikler kazandırır.
Kalsiyum hipokloritin çözünürlüğü
Ca(ClO)2 suda çok çözünür. Suda çözünerek hipoklorit iyonu ve kalsiyum iyonu oluşturur. Ca(ClO)2’nin sudaki çözünürlüğü sıcaklık arttıkça artar. Ca(ClO)2 ayrıca aseton ve etanol gibi organik çözücülerde de çözünür.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 2.35 |
| Renk | Beyaz |
| Koku | Klor kokusu |
| Molar kütle | 142,98 gr/mol |
| Yoğunluk | 2,35 gr/cm³ |
| Füzyon noktası | 100°C |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 21g/100ml (20°C) |
| çözünürlük | Aseton, etanol, gliserol ve suda çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 7.5 |
| pH | ~11 |
Kalsiyum Hipokloritin Güvenliği ve Tehlikeleri
Ca(ClO)2 doğru şekilde kullanılmazsa tehlikeli olabilir. Organik bileşiklerle şiddetli reaksiyona girerek zehirli gazlar açığa çıkarabilen güçlü bir oksidandır. Ciltte ve gözde tahrişe neden olabilir ve uzun süreli maruz kalma solunum problemlerine yol açabilir. Serin, kuru ve iyi havalandırılan bir yerde, organik maddelerden, indirgeyici maddelerden ve asitlerden uzakta saklanmalıdır. Ca(ClO)2 dikkatli bir şekilde kullanılmalı ve kullanılırken eldiven ve gözlük gibi koruyucu ekipmanlar kullanılmalıdır. Patlamaya neden olabileceğinden asitler veya indirgeyici maddeler dahil diğer kimyasallarla karıştırılmamalıdır.
| Tehlike sembolleri | O, Xi, N |
| Güvenlik Açıklaması | Yutulması halinde zararlıdır, cilt tahrişine neden olur, ciddi göz tahrişine neden olur, kansere neden olabilir |
| BM kimlik numaraları | UN1748 |
| HS kodu | 2828.90.00 |
| Tehlike sınıfı | 5.1 (Oksitleyici maddeler) |
| Paketleme grubu | II |
| Toksisite | LD50 (oral, sıçan) = 850 mg/kg; LC50 (soluma, sıçan) = 10,8 mg/m³ (4 saatlik maruz kalma) |
Kalsiyum hipoklorit sentezi için yöntemler
Ca(ClO)2’yi sentezlemek için çeşitli yöntemler vardır.
Yöntemlerden biri, klor gazının suda kalsiyum hidroksit olarak da bilinen sönmüş kireçle karıştırılmasını içerir. Reaksiyon Ca(ClO)2, kalsiyum klorür ve su üretir. Başka bir yöntem, klor gazının kuru kalsiyum hidroksit ile reaksiyona sokulmasını ve sonuçta Ca(ClO)2 ve su buharının elde edilmesini içerir.
Büyük ölçekli Ca(ClO)2 üretim süreci tipik olarak sodyum hipokloritin Ca(ClO)2 ve sodyum klorür üreten kalsiyum klorür ile reaksiyonunu içerir.
Başka bir yöntem, kalsiyum karbonatın su veya asetik asit varlığında klor gazı ile reaksiyona sokulmasını içerir. Reaksiyon Ca(ClO)2, karbondioksit, su veya kalsiyum asetat ve hidroklorik asit üretir.
Bu yöntemler, güvenliği ve etkinliği sağlamak için dikkatli kullanım ve uygun ekipman gerektirir. Yöntemin seçimi, üretimin ölçeğine ve nihai ürünün istenen saflığına bağlıdır.
Kalsiyum Hipokloritin Kullanım Alanları
Ca(ClO)2 güçlü oksitleyici ve dezenfekte edici özelliğinden dolayı geniş bir kullanım alanına sahiptir. Ca(ClO)2’nin bazı yaygın kullanımları şunlardır:
- Su arıtma: Yüzme havuzlarında, içme suyu sistemlerinde ve atık su arıtma tesislerinde suyun dezenfekte edilmesinde yaygın olarak kullanılır.
- Ağartıcı: Pamuk, keten ve kağıt hamurunun yanı sıra kağıt ve tekstil üretiminde ağartma maddesi olarak kullanılır.
- Dezenfeksiyon: Genellikle gıda endüstrisindeki yüzeyleri ve ekipmanları dezenfekte etmek için kullanılır.
- Koku Giderme: Kumaşlardan, halılardan ve diğer malzemelerden hoş olmayan kokuları gidermek için kullanılır.
- Dezenfektan: Hastaneler, laboratuvarlar ve diğer sağlık kuruluşları için etkili dezenfektandır.
- Yosun Kontrolü: Havuzlar ve göller gibi su kütlelerindeki alglerin büyümesini kontrol etmek için kullanılır.
- Kimyasal sentez: Çeşitli organik ve inorganik bileşiklerin sentezinde kullanılır.
- Evsel kullanım: Ev dezenfektanı olarak, özellikle tuvalet ve boruların temizliğinde ve dezenfekte edilmesinde kullanılır.
- Petrol Kuyusu Sondajı: Petrol kuyusu sondajında da bakteri ve diğer mikroorganizmaların büyümesini önlemek için kullanılır.
Sorular:
S: Dövmeyi silmek için kalsiyum hipoklorit kullanabilir misiniz?
C: Hayır, dövme silmek için Ca(ClO)2 kullanılmamalıdır. Ciddi cilt hasarına ve yara izine neden olabilecek güçlü bir oksitleyici maddedir.
S: Kalsiyum hipoklorit’i nasıl depolarım?
C: Ca(ClO)2 serin, kuru, iyi havalandırılmış bir alanda, doğrudan güneş ışığından, ısı kaynaklarından ve uyumsuz maddelerden uzakta saklanmalıdır. İyi kapatılmış bir kapta saklanmalı, nemden ve sudan korunmalıdır.
S: Kalsiyum hipoklorit nereden alınır?
C: Ca(ClO)2 kimyasal tedarik şirketlerinden, yüzme havuzu tedarik mağazalarından ve çevrimiçi perakendecilerden satın alınabilir.
S: İçme suyu için ne kadar kalsiyum hipoklorit?
C: İçme suyu arıtımı için gereken Ca(ClO)2 miktarı, çözeltinin konsantrasyonuna ve arıtılacak suyun hacmine bağlıdır. Düzenli dezenfeksiyon için önerilen dozaj genellikle 0,2 ila 0,5 ppm (milyonda parça) arasındadır.
S: Ne kadar kalsiyum hipokloritin yutulması güvenlidir?
C: Ca(ClO)2 asla yutulmamalıdır çünkü oldukça zehirlidir ve ciddi sağlık sorunlarına ve hatta ölüme neden olabilir.
S: Kalsiyum hipoklorit ile su arıtma?
C: Ca(ClO)2, yüzme havuzları, içme suyu sistemleri ve atık su arıtma tesisleri de dahil olmak üzere çeşitli ortamlarda su arıtma ve dezenfeksiyonu için yaygın olarak kullanılır.
S: Kalsiyum hipoklorit şoku mu?
C: Ca(ClO)2 şoku, klor seviyelerini hızlı bir şekilde artırmak ve zararlı bakterileri ve kirletici maddeleri ortadan kaldırmak için bir havuza veya spaya daha yüksek konsantrasyonda Ca(ClO)2 ekleme işlemidir.
S: Suyu dezenfekte etmek için kalsiyum hipoklorit mi?
C: Ca(ClO)2, bakterileri, virüsleri ve diğer zararlı mikroorganizmaları yok etmek amacıyla su arıtma ve saflaştırmada sıklıkla kullanılan güçlü bir dezenfektandır.
Soru: Ca(OCl)2 asit mi yoksa baz mı?
C: Kalsiyum hipoklorit (Ca(OCl)2) bir bazdır çünkü bir protonu kabul ederek bir hidroksit iyonu oluşturabilir.
S: Deneyin sonunda Ca(OCl)2’nin hangi indirgenmiş formu kalır?
C: Bir deneyin sonunda kalan Ca(OCl)2’nin indirgenmiş formu, gerçekleşen spesifik reaksiyona bağlıdır. Bazı durumlarda kalsiyum klorür (CaCl2) veya kalsiyum karbonat (CaCO3) olabilir.
