Kalsiyum bromür, CaBr2 formülüne sahip kimyasal bir bileşiktir. Çeşitli endüstrilerde bromür iyonlarının kaynağı olarak kullanılan beyaz, kokusuz, çözünür bir katıdır.
| IUPAC’ın adı | Kalsiyum bromür |
| Moleküler formül | CaBr2 |
| CAS numarası | 7789-41-5 |
| Eş anlamlı | Kalsiyum dibromid; Bromokalsiyum |
| InChI | InChI=1S/Ca.2BrH/h;2*1H/q+2;;/p-2 |
Kalsiyum bromürün özellikleri
Kalsiyum Bromür Formülü
Kalsiyum bromürün kimyasal formülü CaBr2’dir. Bu formül, bir kalsiyum iyonunun iki bromür iyonuna iyonik bağlarla bağlandığını gösterir. Bir bileşiğin formülü, bileşiğin bir molekülünde veya formül biriminde mevcut olan atomların türlerini ve sayısını temsil eder.
Kalsiyum Bromür Molar Kütle
CaBr2’nin molar kütlesi 199,89 g/mol’dür. Bu değer, bir kalsiyum atomunun (40,08 g/mol) ve iki bromin atomunun (her biri 79,90 g/mol) atomik kütlelerinin eklenmesiyle hesaplanır. Molar kütle herhangi bir kimyasal bileşiğin çok önemli bir özelliğidir çünkü bileşiğin bir molünde bulunan madde miktarını belirler.
Kalsiyum bromürün kaynama noktası
CaBr2’nin kaynama noktası 1193°C’dir (2179°F). CaBr2 iyonik yapısından dolayı yüksek kaynama noktasına sahiptir. İyonik bileşikler pozitif ve negatif yüklü iyonları arasında güçlü elektrostatik kuvvetlere sahiptir. Bu kuvvetlerin parçalanması için çok fazla enerji gerekir ve bu da yüksek kaynama noktasına neden olur.
Kalsiyum bromürün erime noktası
CaBr2’nin erime noktası 730°C’dir (1,346°F). Bir bileşiğin erime noktası, onun katı halden sıvı hale geçtiği sıcaklıktır. CaBr2 iyonik yapısından dolayı nispeten yüksek bir erime noktasına sahiptir. İyonları arasındaki güçlü elektrostatik kuvvetlerin üstesinden gelmek için çok fazla enerji gerekir, bu da yüksek bir erime noktasına neden olur.
Kalsiyum bromürün yoğunluğu g/mL
CaBr2’nin yoğunluğu 3,353 g/mL’dir. Yoğunluk, bir maddenin birim hacim başına kütlesidir. CaBr2’nin yüksek yoğunluğu iyonik yapısından ve iyonlarının sıkı dizilişinden kaynaklanmaktadır.
Kalsiyum Bromür Molekül Ağırlığı
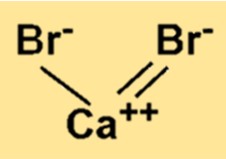
CaBr2’nin moleküler ağırlığı 199,89 g/mol’dür. Bu değer, bir kalsiyum atomu ve iki brom atomunun atomik kütleleri toplanarak hesaplanır. Molekül ağırlığı herhangi bir kimyasal bileşiğin temel bir özelliğidir çünkü bileşiğin bir molekülünde mevcut olan madde miktarını belirler.
Kalsiyum bromürün yapısı
CaBr2, Ca2+ ve Br− iyonlarından oluşan kristal bir kafes yapısına sahiptir. Ca2+ iyonları altı Br− iyonuyla çevrilidir ve her bir Br− iyonu altı Ca2+ iyonuyla çevrilidir. İyonların bu düzenlenmesi aralarında güçlü bir iyonik bağ oluşmasına neden olur.
| Dış görünüş | Beyaz katı |
| Spesifik yer çekimi | 3.353 g/mL |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 199,89 gr/mol |
| Yoğunluk | 3.353 g/mL |
| Füzyon noktası | 730°C (1,346°F) |
| Kaynama noktası | 1.193°C (2.179°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çok çözünür |
| çözünürlük | Alkol, aseton ve eterde çözünür |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | Uygulanamaz |
| pH | 7 (nötr) |
Kalsiyum bromürün güvenliği ve tehlikeleri
CaBr2, doğru şekilde kullanıldığında genellikle güvenli kabul edilir. Ancak doğru şekilde kullanılmadığı veya kullanılmadığı takdirde bazı sağlık riskleri oluşturabilir. CaBr2’nin solunması veya yutulması sırasıyla solunum yolunu ve mide-bağırsak sistemini tahriş edebilir. CaBr2 ile uzun süreli cilt teması tahrişe ve dermatite neden olabilir. CaBr2 ayrıca güçlü oksitleyici maddelerle şiddetli reaksiyona girerek zehirli gazlar açığa çıkarabilir. CaBr2 ile çalışırken eldiven ve gözlük gibi uygun kişisel koruyucu ekipmanlar giyilmelidir. Ayrıca uyumsuz maddelerden uzakta, serin, kuru, iyi havalandırılmış bir alanda saklanmalıdır.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Cilt tahrişine neden olur. Ciddi göz tahrişine neden olur. Yutulması veya solunması halinde zararlıdır. Solunum yolu tahrişine neden olabilir. |
| BM kimlik numaraları | UN3261 |
| HS kodu | 28275900 |
| Tehlike sınıfı | 8 (aşındırıcı) |
| Paketleme grubu | III |
| Toksisite | Düşük ila orta derecede toksisite. |
Kalsiyum bromürün sentezi için yöntemler
CaBr2’yi sentezlemek için farklı yöntemler vardır, ancak en yaygın olanı kalsiyum karbonat veya kalsiyum hidroksit ile hidrobromik asit arasındaki reaksiyonu içerir. Bu işlem, tek yan ürün olarak CaBr2 ve su üretir. Reaksiyon, reaktanların tam dönüşümünü sağlamak için sürekli karıştırma ve ısıtma ile kontrollü bir ortamda gerçekleşir.
Başka bir yöntem, kalsiyum oksit ile hidrobromik asit arasındaki reaksiyonu içerir. Bu işlem aynı zamanda yan ürün olarak CaBr2 ve su üretir. Reaksiyon ilk yönteme benzer ve sürekli karıştırma ve ısıtma gerektirir.
Üçüncü bir yöntem, kalsiyum ve brom arasındaki reaksiyonu içerir. Bromun yüksek reaktivitesi ve dikkatli kullanım ihtiyacı, bu yöntemin daha az yaygın olarak kullanılmasını sağlar. Reaksiyon tek ürün olarak CaBr2 üretir.
Bu yöntemlerin tümü, tehlikeli kimyasallar ve potansiyel olarak tehlikeli reaksiyonlar içerdiğinden dikkatli kullanım ve güvenlik önlemleri gerektirir. Sentezlenen CaBr2, herhangi bir safsızlığın giderilmesi ve saflığının sağlanması için kullanımdan önce saflaştırılmalıdır. Nihai ürünün saflığı, amaçlanan uygulama için kalitesini ve etkinliğini belirler.
Kalsiyum Bromürün Kullanım Alanları
CaBr2, benzersiz kimyasal özelliklerinden dolayı farklı endüstrilerde çeşitli uygulamalar bulur. CaBr2’nin yaygın kullanımlarından bazıları şunlardır:
- Petrol ve Gaz Endüstrisi: Petrol ve gaz endüstrisinde sondaj ve tamamlama işlemleri sırasında kuyu içi basınçlarını kontrol etmek için tamamlama sıvısı olarak kullanılır.
- Tıp: Epilepsi ve diğer sinir sistemi bozukluklarını tedavi etmek için tıbbi olarak sakinleştirici ve antikonvülsan ilaç olarak kullanılır.
- Fotoğrafçılık: Fotoğrafçılıkta gümüş bromür emülsiyonlarının hazırlanmasında hassaslaştırıcı olarak kullanılır.
- Kimyasal sentez: Esterifikasyon, alkilasyon ve yoğunlaşma dahil çeşitli kimyasal reaksiyonlarda katalizör olarak kullanılır.
- Alev Geciktirici: Plastik, tekstil ve diğer malzemelerde yangın riskini azaltmak için alev geciktirici olarak kullanılır.
- Gıda Endüstrisi: Mikrobiyal büyümeyi ve bozulmayı önlemek amacıyla gıda koruyucusu olarak kullanılır.
- Soğutma: Absorbsiyonlu soğutma sistemlerinde soğutucu olarak kullanılır.
- Su Arıtma: Yüzme havuzları ve diğer su sistemlerinde yosun ve bakteri üremesini önlemek amacıyla su arıtımında kullanılır.
Sorular:
S: Kalsiyum bromür bileşiğini hangi formül temsil eder?
C: Kalsiyum bromürün kimyasal formülü CaBr2’dir.
S: Kalsiyum bromür suda çözünür mü?
C: Evet, CaBr2 suda çözünür. Suda yüksek çözünürlüğe sahiptir ve 20°C’de yaklaşık 121 g/100 mL’lik bir çözünürlüğe sahiptir.
S: Kalsiyum bromür sulu mu?
C: CaBr2, suda çözündüğünde sulu bir çözelti oluşturarak sulu bir halde bulunabilir.
S: Kalsiyum bromür çözünür mü?
C: Evet, CaBr2 su, etanol ve aseton dahil olmak üzere çeşitli solventlerde çözünür.
S: Kalsiyum bromür ve potasyum fosfatın sulu çözeltileri karıştırıldığında hangi çökelti oluşur?
C: CaBr2 ve potasyum fosfatın sulu çözeltileri karıştırıldığında beyaz bir kalsiyum fosfat çökeltisi oluşur. Bu reaksiyonun dengeli kimyasal denklemi şöyledir:
CaBr2(sulu) + K3PO4(sulu) → 2KBr(sulu) + Ca3(PO4)2(ler)
