Kalsiyum bikarbonat (Ca(HCO3)2), kalsiyum, karbon ve oksijen içeren bir bileşiktir. Maden suyunda yaygın olarak bulunur ve kemik sağlığı ve kas fonksiyonu için önemlidir.
| IUPAC Adı | Kalsiyum hidrojen karbonat |
| Moleküler formül | Ca(HCO3)2 |
| CAS numarası | 3983-19-5 |
| Eş anlamlı | Kalsiyum hidrojen karbonat, kalsiyum hidrojen karbonat, hidratlı kalsiyum bikarbonat, hidratlı kalsiyum hidrojen karbonat, EINECS 223-070-3 |
| InChI | InChI=1S/C2H2O3.Ca/c3-1(4)2(5)6;/h(H2,3,4)(H,5,6);/q;+2/p-2 |
Kalsiyum bikarbonatın özellikleri
Kalsiyum Bikarbonat Formülü
Kalsiyum bikarbonatın kimyasal formülü Ca(HCO3)2’dir. Bu, bileşiğin bir Ca2+ iyonu ve iki HCO3- iyonundan oluştuğunu gösterir. Formül, bileşiğin bileşimini ve kimyasal özelliklerini anlamak için önemlidir. Ca(HCO3)2, kalsiyum karbonatın karbonatlı suda çözülmesiyle veya kalsiyum hidroksitin karbon dioksitle reaksiyona sokulmasıyla oluşturulabilir.
Kalsiyum Bikarbonat Molar Kütlesi
Ca(HCO3)2’nin molar kütlesi 162.114 g/mol’dür. Bu, bileşikteki her bir elementin atomik kütlelerinin eklenmesiyle hesaplanır. Ca(HCO3)2 kalsiyum, hidrojen, karbon ve oksijen atomlarını içerir ve molar kütle bu atomların hepsinin birleşik kütlesini yansıtır. Molar kütlenin bilinmesi, kimyasal reaksiyonlar için gerekli olan Ca(HCO3)2 miktarının belirlenmesi veya bir çözeltinin konsantrasyonunun belirlenmesi açısından önemlidir.
Kalsiyum bikarbonatın kaynama noktası
Ca(HCO3)2 kaynama noktasına ulaşamadan ayrışır. Normal atmosfer basıncında Ca(HCO3)2, 50°C’nin üzerindeki sıcaklıklarda kalsiyum karbonat, su ve karbondioksite ayrışır. Bu nedenle kaynama noktası yoktur.
Kalsiyum Bikarbonat Erime Noktası
Ca(HCO3)2 erime noktasına ulaşmadan ayrıştığı için belirgin bir erime noktası yoktur. 50°C’nin üzerindeki sıcaklıklarda kalsiyum karbonat, su ve karbondioksite ayrışır. Bununla birlikte, Ca(HCO3)2’nin termal ayrışması, 2613°C gibi yüksek bir erime noktasına sahip olan kalsiyum oksit üretmek için kullanılabilir.
Kalsiyum bikarbonatın yoğunluğu g/mL
Ca(HCO3)2’nin yoğunluğu 2,21 g/mL’dir. Bu, bir santimetreküp Ca(HCO3)2’nin 2,21 gram ağırlığında olduğu anlamına gelir. Ca(HCO3)2’nin yoğunluğu, 2,71 g/mL olan kalsiyum karbonatın yoğunluğundan düşüktür. Bir maddenin yoğunluğu, bir maddenin birim hacim başına kütlesinin belirlenmesinde önemlidir ve bir çözeltinin konsantrasyonunu hesaplamak için kullanılabilir.
Kalsiyum Bikarbonat Molekül Ağırlığı
Ca(HCO3)2’nin molekül ağırlığı 162.114 g/mol’dür. Bu değer, bileşikteki kalsiyum, hidrojen, karbon ve oksijenin atom ağırlıklarının eklenmesiyle hesaplanır. Molekül ağırlığı, kimyasal reaksiyonlar için gerekli olan Ca(HCO3)2 miktarının belirlenmesinde ve bir çözeltinin konsantrasyonunun belirlenmesinde önemlidir.
Kalsiyum bikarbonatın yapısı
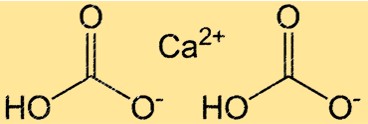
Ca(HCO3)2 iyonik ve kovalent bağların varlığı nedeniyle karmaşık bir yapıya sahiptir. Bileşik, iyonik bağlarla bir arada tutulan bir Ca2+ iyonu ve iki HCO3- iyonundan oluşur. HCO3- iyonunun kendisi bir karbon atomu, iki oksijen atomu ve bir hidrojen atomundan oluşan çok atomlu bir iyondur. Karbon atomu bir oksijen atomuna çift, diğerine tek bağlıdır ve hidrojen atomu oksijen atomlarından birine bağlanmıştır. Ca(HCO3)2’nin yapısı onun sudaki reaktivitesini ve çözünürlüğünü anlamak açısından önemlidir.
| Dış görünüş | Beyaz toz |
| Spesifik yer çekimi | 2,21 g/cm³ |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 162.114 gr/mol |
| Yoğunluk | 2.21g/ml |
| Füzyon noktası | 50°C’nin üzerinde ayrışır |
| Kaynama noktası | 50°C’nin üzerinde ayrışır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çözünür |
| çözünürlük | Suda çözünür, alkolde çözünmez |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 6.4 – 10.3 |
| pH | 8.2 – 8.4 |
Kalsiyum bikarbonatın güvenliği ve tehlikeleri
Ca(HCO3)2’nin yiyecek ve içeceklerde kullanımı düzenleyici kurumlar tarafından genellikle güvenli kabul edilmektedir. Ancak Ca(HCO3)2 tozunun solunması solunum yolu tahrişine neden olabilir. Gözlerle teması kornea tahrişine veya hasarına neden olabilir. Büyük miktarlarda Ca(HCO3)2’nin yutulması mide-bağırsak tahrişine neden olabilir. Ca(HCO3)2’nin kullanılması hassas kişilerde cilt tahrişine veya dermatite de neden olabilir. Ca(HCO3)2 ile çalışırken eldiven ve koruyucu gözlük takmak gibi uygun kullanım prosedürlerini takip etmek önemlidir. Ayrıca Ca(HCO3)2’nin serin, kuru bir yerde ve uyumsuz maddelerden uzakta saklanması önemlidir.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Toksik olmayan ve güvenli |
| BM kimlik numaraları | Yok |
| HS kodu | 2836.50.00 |
| Tehlike sınıfı | Tehlikeli değil |
| Paketleme grubu | Yok |
| Toksisite | Toksik olmayan ve güvenli |
Kalsiyum bikarbonatın sentezi için yöntemler
Kalsiyum karbonatın (CaCO3) karbondioksit (CO2) ve su (H2O) ile reaksiyonundan Ca(HCO3)2 sentezlenir. Bu reaksiyon, karbondioksit ve kalsiyum karbonatın mevcut olduğu belirli su kütlelerinde doğal olarak meydana gelebilir.
Ca(HCO3)2 üretmek için karbondioksit, bir kalsiyum hidroksit (Ca(OH)2) çözeltisinden geçirilebilir. Bu reaksiyon kalsiyum karbonatı oluşturur ve bu daha sonra fazla karbondioksitle reaksiyona girerek Ca(HCO3)2 oluşturur.
Ca(HCO3)2’yi sentezlemenin başka bir yöntemi , kalsiyum klorürün (CaCl2) sodyum bikarbonat (NaHCO3) ile reaksiyona sokulmasını içerir. Bu reaksiyon Ca(HCO3)2’nin yanı sıra sodyum klorür (NaCl) ve karbondioksit üretir.
Ca(HCO3)2’nin nispeten kararsız bir bileşik olduğunu ve ısı veya asidik koşullar altında kalsiyum karbonat ve karbon dioksite ayrıştığını belirtmek önemlidir. Ayrışmayı önlemek için Ca(HCO3)2 dikkatle kullanılmalı ve saklanmalıdır.
Kalsiyum Bikarbonatın Kullanım Alanları
Ca(HCO3)2’nin bazı yaygın kullanımları şunlardır:
- Yiyecek ve İçecek: Bazı unlu mamullerin, bırakıcıların ve meşrubatların üretiminde gıda katkı maddesi olarak kullanılır.
- Su Arıtma: Suyun alkalinitesini arttırmak için kullanılır, bu da boru korozyonunu önlemeye ve asitli su kaynaklarının asitliğini azaltmaya yardımcı olur.
- Tarım: Toprağın kalsiyum içeriğini arttırmak için toprak iyileştirici olarak kullanılır, bu da toprak yapısını ve bitki büyümesini iyileştirir.
- Farmasötikler: Bazı antiasit formülasyonlarında, mide yanmasını ve hazımsızlığı gidermeye yardımcı olmak için nötrleştirici bir madde olarak kullanılır.
- İnşaat: Çimento ve alçı gibi bazı inşaat malzemelerinin üretiminde kalsiyum kaynağı olarak kullanılır.
- Temizleme: Diş macunu ve temizleme tozları gibi bazı temizlik ürünlerinde hafif aşındırıcı olarak kullanılır.
- Kozmetikler: Bazı kozmetik formülasyonlarda ürün pH’ının korunmasına yardımcı olmak için tamponlama maddesi olarak kullanılır.
Sorular:
Soru: Kalsiyum bikarbonat nedir?
C: Ca(HCO3)2, kalsiyum karbonatın karbondioksit ve suyla reaksiyona girmesiyle oluşan beyaz kristal bir tozdur.
Soru: Kalsiyum bikarbonat oluşturmak için hangi üç maddenin etkileşime girmesi gerekir?
C: Kalsiyum karbonat, karbondioksit ve suyun etkileşime girerek Ca(HCO3)2 oluşturması gerekir.
S: Kalsiyum bikarbonat bir mayalanma maddesi midir?
C: Evet, Ca(HCO3)2 pişirme işleminde hamurun kabarmasına yardımcı olmak için bir ayırıcı madde olarak kullanılabilir.
S: Kalsiyum bikarbonat kulak kristalleri hiç çözülür mü?
C: Evet, kulak Ca(HCO3)2 kristalleri kendi başlarına veya örneğin belirli ilaçların veya manevraların kullanılmasıyla tedaviyle çözülebilir.
Soru: Bir mol Ca(HCO3)2’deki atomların toplam mol sayısı nedir?
Cevap: Bir mol Ca(HCO3)2’de 10 mol atom vardır.
Soru: Ca(HCO3)2’de kaç atom var?
C: Ca(HCO3)2’de 1 kalsiyum atomu, 2 karbon atomu, 6 hidrojen atomu ve 9 oksijen atomu olmak üzere toplam 18 atom bulunmaktadır.
S: Ca(HCO3)2 nedir?
C: Ca(HCO3)2, kalsiyum karbonatın karbondioksit ve suyla reaksiyona girmesiyle oluşan bir bileşik olan kalsiyum bikarbonatın kimyasal formülüdür.
