Hidroiyodik asit (HI), hidrojen ve iyottan oluşan güçlü bir asittir. Organik sentezde ve indirgeyici madde olarak kullanılır. Çok aşındırıcıdır ve dikkatli kullanım gerektirir.
| IUPAC Adı | Hidroiyodik asit |
| Moleküler formül | MERHABA |
| CAS numarası | 10034-85-2 |
| Eş anlamlı | Hidroiyodik asit, hidrojen iyodür, iyodan |
| InChI | InChI=1S/HI/h1H |
Hidroiyodik asidin özellikleri
Hidroiyodik Asit Formülü
Hidrojen iyodürün kimyasal formülü HI’dır. Bir iyot (I) atomuna bağlı bir hidrojen (H) atomundan oluşur. Bu basit formül, bu güçlü asidin bileşimini temsil eder.
Hidroiyodik Asit Molar Kütlesi
Hidrojen iyodürün (HI) molar kütlesi mol başına yaklaşık 127,91 gramdır (g/mol). Bu değer, bir hidrojen atomunun ve bir iyot atomunun atomik kütlelerinin eklenmesiyle hesaplanır.
Hidroiyodik asidin kaynama noktası
Hidrojen iyodür, -35 santigrat derece (-31 Fahrenheit derece) civarında, nispeten düşük bir kaynama noktasına sahiptir. Bu sıcaklıkta HI’nın sıvı formu gaz haline dönüşür.
Hidroiyodik asit Erime noktası
Hidrojen iyodürün erime noktası yaklaşık -51 santigrat derecedir (-60 derece Fahrenheit). Bu sıcaklıkta HI’nın katı formu sıvı duruma dönüşür.
Hidroiyodik asit yoğunluğu g/mL
Hidrojen iyodürün yoğunluğu mililitre başına yaklaşık 2,85 gramdır (g/mL). Bu yoğunluk ölçümü, maddenin bir mililitresinde bulunan HI kütlesini gösterir.
Hidroiyodik asit Molekül ağırlığı
Hidrojen iyodürün moleküler ağırlığı yaklaşık 127,91 g/mol’dür. Bu değer, HI molekülündeki hidrojen ve iyotun atom ağırlıklarının toplamıdır.
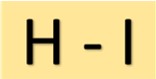
Hidroiyodik asidin yapısı
Hidroiyodik asit (HI) basit bir yapıya sahiptir. Bir iyot atomuna tek bir kovalent bağ ile bağlanan bir hidrojen atomundan oluşur. Bu moleküler düzenleme HI’ya karakteristik özelliklerini verir.
Hidroiyodik asidin çözünürlüğü
Hidroiyodik asit suda yüksek çözünürlüğe sahiptir. Su ile karıştırıldığında kolayca çözünerek renksiz bir çözelti oluşturur. Yüksek çözünürlüğü, kimyasal sentez dahil çeşitli uygulamalarda yaygın kullanımına katkıda bulunur.
| Dış görünüş | Renksiz sıvı |
| Spesifik yer çekimi | 2.85g/ml |
| Renk | Renksiz |
| Koku | Dönüm |
| Molar kütle | 127,91 gr/mol |
| Yoğunluk | 2.85g/ml |
| Füzyon noktası | -51°C (-60°F) |
| Kaynama noktası | -35°C (-31°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Karışabilir, renksiz bir çözelti oluşturur |
| çözünürlük | Organik çözücülerde çözünür |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | -on |
| pH | Çok asidik (pH < 1) |
Hidroiyodik Asitin Güvenliği ve Tehlikeleri
Hidrojen iyodür (HI), aşındırıcı yapısı nedeniyle önemli güvenlik riskleri oluşturur. Temas halinde ciddi cilt yanıklarına ve göz hasarına neden olabilir. Buharlarının solunması solunum yolu tahrişine neden olur. HI ile çalışırken eldiven ve gözlük gibi uygun koruyucu ekipmanlar kullanılmalıdır. Uyumsuz maddelerden uzakta, iyi havalandırılmış bir alanda saklanmalıdır. Yanlışlıkla yutulursa veya solunursa derhal tıbbi yardım alın. Dökülmesi halinde uygun maddelerle nötralize edin ve tehlikeli atık olarak imha edin. Kazaları ve yaralanmaları önlemek için sıkı güvenlik protokollerine uymak ve dikkatli davranmak önemlidir.
| Tehlike sembolleri | Aşındırıcı |
| Güvenlik Açıklaması | Ciddi cilt yanıklarına ve göz hasarına neden olur. Solunması halinde zararlıdır. |
| BM kimlik numaraları | UN1787 |
| HS kodu | 28111990 |
| Tehlike sınıfı | 8 (Aşındırıcı maddeler) |
| Paketleme grubu | II |
| Toksisite | Çok zehirli |
Hidroiyodik asit sentezi için yöntemler
Hidrojen iyodür (HI) çeşitli yöntemlerle sentezlenebilir. Yaygın bir yaklaşım, iyotun (I2) kırmızı fosfor (P) ile doğrudan reaksiyonunu içerir. Bu yöntemde I2, indirgeyici madde görevi gören kırmızı fosfor ile karıştırılır. Reaksiyon suyun varlığında gerçekleşir ve HI ve fosforik asit verir.
Başka bir yöntem, iyotun hidrazin hidrat (N2H4·H2O) ile reaksiyonunu içerir. Bu işlem, hidrazin hidratın potansiyel olarak tehlikeli yapısından dolayı dikkatli bir işlem gerektirir. Reaksiyon HI ve nitrojen gazı oluşumuyla sonuçlanır.
Alternatif olarak iyotun konsantre sülfürik asit (H2SO4) ile reaksiyonu da HI üretebilir. Bu yöntemde iyot, konsantre sülfürik asit ile karıştırılarak toplanıp sıvı formda yoğunlaştırılabilen HI gazının oluşmasına yol açar.
Hidrojen iyodür sentezinin uygun güvenlik önlemleriyle gerçekleştirilmesi gerektiğine dikkat etmek önemlidir. İlgili kimyasallar tehlikeli olabilir ve reaksiyonlar zehirli gazlar üretebilir. Hidrojen iyodürün güvenli ve başarılı bir şekilde üretilmesini sağlamak için sentez işlemi sırasında uygun havalandırma, koruyucu ekipman ve güvenlik önlemlerine uyulması çok önemlidir.
Hidroiyodik Asitin Kullanım Alanları
Hidrojen iyodür (HI), benzersiz özellikleri nedeniyle çeşitli endüstrilerde çeşitli uygulamalar bulur. İşte bazı temel kullanımlar:
- Organik sentez: Organik kimya, halojensizleştirme olarak bilinen bir işlem olan alkil halojenürleri alkanlara dönüştürmek için temel bir reaktan olarak HI’yı kullanır.
- İlaç Endüstrisi: HI ile ilgili tıbbi görüntüleme için iyot içeren ilaçlar ve iyotlu kontrast maddeler de dahil olmak üzere çeşitli farmasötik bileşiklerin üretimi.
- İndirgeyici madde: HI, kimyasal reaksiyonlarda güçlü bir indirgeyici madde olarak aktif olarak işlev görür ve metal iyonlarının elementel formlarına indirgenmesine yardımcı olur.
- Kataliz: HI, belirli kimyasal reaksiyonlara katalizör olarak aktif olarak katılarak reaksiyon hızlarını arttırır ve spesifik dönüşümlerin verimini artırır.
- Temizleme ve Dağlama: Elektronik ve yarı iletken endüstrileri, metalleri ve metal oksitleri çözme yeteneğinden dolayı temizleme ve dağlama işlemleri için aktif olarak HI’yı kullanır.
- Analitik kimya: Analitik kimyadaki iyodometrik titrasyonlar, belirli maddelerin iyotla reaksiyonlarına dayalı olarak konsantrasyonlarını belirlemek için aktif olarak HI’yı kullanır.
- Metal Yüzey İşlemi: HI, metal yüzeylerin kaplama, lehimleme ve diğer yüzey işleme işlemlerine hazırlanmasında aktif olarak rol oynar.
- İyodür Üretimi: Çeşitli endüstriler, fotoğrafçılık, tıp ve organik sentez gibi alanlardaki çeşitli uygulamalara yönelik iyodür bileşikleri üretmek için aktif olarak HI’yı kullanır.
- Laboratuvar Reaktifi: Laboratuvarlar HI’yi birçok kimyasal reaksiyon ve deney için yararlı bir reaktif olarak aktif olarak kullanır.
Hidrojen iyodürün çok yönlü özellikleri, onu kimyasal araştırmalarda, endüstriyel süreçlerde ve farmasötik geliştirmede değerli bir araç haline getirerek birçok sektördeki ilerlemelere ve bilimsel keşiflere katkıda bulunur.
Sorular:
S: Asidik özelliklerini nötralize etmek için hidriyodik asit (HI)’ye hangi bileşik eklenebilir?
C: Hidrojen iyodidi nötralize etmek ve su ve tuz oluşturmak için sodyum hidroksit (NaOH) gibi bir baz eklenebilir.
S: Hidroiyodik asit güçlü bir asit midir?
C: Evet, hidrojen iyodür güçlü bir asittir, yani suda tamamen iyonlaşarak hidrojen iyonları açığa çıkarır.
Soru: Hidroiyodik asidin formülü nedir?
A: Hidrojen iyodürün formülü HI’dır ve bir iyot atomuna bağlı bir hidrojen atomunu temsil eder.
Soru: Hidroiyodik asidin formülü aşağıdakilerden hangisidir?
A: Hidrojen iyodürün formülü HI’dır.
S: 10,00 ml 0,217 M CsOH ile reaksiyona girmek için kaç mililitre 0,550 M hidriyodik asit gereklidir?
A: 10,00 ml 0,217 M CsOH ile reaksiyona girmek için yaklaşık 17,58 ml 0,550 M hidrojen iyodür gereklidir.
S: Hidroiyodik asit yasa dışı mıdır?
C: Hidrojen iyodürün kendisi yasa dışı değildir ancak potansiyel tehlikeleri ve yasa dışı faaliyetlerdeki uygulamaları nedeniyle kullanımı ve bulundurulması düzenlenebilir.
S: Hidrojen iyodür ve magnezyum sülfür ne oluşturur?
A: Hidrojen iyodür ve magnezyum sülfit reaksiyona girerek hidrojen sülfit (H2S) gazı ve magnezyum iyodür tuzu (MgI2) oluşturur.
S: Hidrojen iyodidi karbonatla karıştırdığınızda ne olur?
C: Hidrojen iyodür kabartma tozu (sodyum bikarbonat) ile reaksiyona girdiğinde karbondioksit, su ve sodyum iyodür üretir.
S: Hidrojen iyodür suda nasıl çalışır?
C: Hidrojen iyodür suda iyonlaşarak hidrojen iyonlarını (H+) ve iyodür iyonlarını (I-) açığa çıkarır ve sonuçta çok asidik bir çözelti oluşur.
S: Sodyum hidroksit ve hidrojen iyodürün net iyonik denklemi?
A: Sodyum hidroksit (NaOH) ile hidrojen iyodür (HI) arasındaki reaksiyonun net iyonik denklemi Na+ + OH- + H+ + I- → Na+ + I- + H2O’dur.
