Hidrazoik asit (HN3) oldukça uçucu bir bileşiktir. Renksizdir ve keskin bir kokusu vardır. Kimyasal reaksiyonlarda kullanılır ve toksik ve patlayıcı olabilir.
| IUPAC Adı | Hidrazoik asit |
| Moleküler formül | HN3 |
| CAS numarası | 7782-79-8 |
| Eş anlamlı | Azoimid, hidrojen azid, azotik asit, hidronitrik asit, triazoik asit |
| InChI | InChI=1S/HN3/c1-3-2/h1H |
Hidrazoik asidin özellikleri
Hidrazoik Asit Formülü
Hidrazoik asidin kimyasal formülü HN3’tür. Bir hidrojen atomu ve üç nitrojen atomunun kovalent olarak birbirine bağlanmasıyla oluşur. Bu basit formül, bileşiğin özelliklerini ve reaksiyonlarını anlamak için çok önemli olan temel bileşimini temsil eder.
Hidrazoik Asit Molar Kütlesi
Hidrojen azidin (HN3) molar kütlesi mol başına yaklaşık 43.03 gramdır. Bu değer, bir hidrojen atomunun (H) ve üç nitrojen atomunun (N) atomik kütlelerinin eklenmesiyle elde edilir. Molar kütle, kimyasal reaksiyonlarda stokiyometrinin hesaplanması için gereklidir.
Hidrazoik asidin kaynama noktası
Hidrojen azit, yaklaşık 37 santigrat derece (98,6 Fahrenheit derece) civarında nispeten düşük bir kaynama noktasına sahiptir. Uçucu yapısı nedeniyle orta sıcaklıklarda kolayca gaz halinde buharlaşır. Bu bileşiği kullanırken çok dikkatli olunması gerekir.
Hidrazoik asit Erime noktası
Hidrojen azidin erime noktası -80 santigrat derece (-112 Fahrenheit) civarındadır. Bu sıcaklıkta katı bileşik sıvı forma dönüşür. Oldukça reaktif olduğundan katı hali uygun depolama ve taşıma gerektirir.
Hidrazoik asit yoğunluğu g/mL
Hidrojen azidin yoğunluğu mililitre başına yaklaşık 1,09 gramdır. Bu değer, birim hacim başına kütlesini gösterir ve belirli bir alandaki kompaktlığını ve konsantrasyonunu yansıtır. Laboratuvar ölçümleri için kritik bir parametredir.
Hidrazoik Asit Molekül Ağırlığı
Hidrojen azidin (HN3) moleküler ağırlığı mol başına 43.03 gramdır. Bileşiğin tek bir molekülünde bulunan elementlerin atom ağırlıklarının toplamıdır. Molekül ağırlığı, fiziksel ve kimyasal davranışlarının belirlenmesinde hayati bir rol oynar.
Hidrazoik asidin yapısı
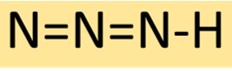
Hidrojen azid, sonunda tek bir hidrojen atomuyla sırayla bağlanan üç nitrojen atomundan oluşan doğrusal bir moleküler yapıya sahiptir. Bu düzenleme, genellikle kimyasal sentezlerde kullanılan, kararlı ancak oldukça reaktif bir bileşikle sonuçlanır.
Hidrazoik asidin çözünürlüğü
Hidrojen azidin suda çözünürlüğü sınırlıdır, bu da onu az çözünür bir bileşik haline getirir. Sulu çözeltilerde az miktarda çözünebilir ancak çözünürlüğünün düşük olması bazı uygulamalarda kullanımını sınırlamaktadır. Toksik ve patlayıcı yapısından dolayı sulu formuyla uğraşırken özel dikkat gereklidir.
| Dış görünüş | Renksiz sıvı |
| Spesifik yer çekimi | 1.09g/ml |
| Renk | Renksiz |
| Koku | Keskin koku |
| Molar kütle | 43,03 g/mol |
| Yoğunluk | 1.09g/ml |
| Füzyon noktası | -80°C (-112°F) |
| Kaynama noktası | 37°C (98,6°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Az çözünür |
| çözünürlük | Alkol, eter gibi alkali ve organik çözücülerde çözünür |
| Buhar basıncı | 20°C’de 23,1 mmHg |
| Buhar yoğunluğu | 1,4 (hava = 1) |
| pKa | 4.6 |
| pH | Yaklaşık 3-4 |
Hidrazoik Asitin Güvenliği ve Tehlikeleri
Hidrojen azit önemli güvenlik riskleri oluşturur. Oldukça toksiktir ve maruz kalınması halinde sağlık üzerinde ciddi etkilere neden olabilir. Buharlarının veya buğularının solunması solunum yolu tahrişine, baş dönmesine ve hatta ölüme neden olabilir. Cilt veya gözlerle teması yanıklara, tahrişe ve doku hasarına neden olabilir. Bileşik ayrıca son derece yanıcıdır ve patlayıcı karışımlar oluşturabilir. Metaller ve oksitleyici maddeler gibi çeşitli maddelerle şiddetli reaksiyona girer. Hidrojen azit kullanılırken koruyucu kıyafet giymek, yeterli havalandırma kullanmak ve kazaları veya çevreye salınımını önlemek için güvenli bir şekilde saklamak da dahil olmak üzere uygun güvenlik önlemleri izlenmelidir. Çevre.
| Tehlike sembolleri | Kafatası ve Kemiklerin, Aşındırıcı |
| Güvenlik Açıklaması | Çok zehirli, aşındırıcı |
| BM kimlik numaraları | UN1687 |
| HS kodu | 2811.29.10 |
| Tehlike sınıfı | 6.1 (Zehirli maddeler) |
| Paketleme grubu | II (Orta tehlike) |
| Toksisite | Çok zehirli; küçük miktarlarda ölümcül olabilir |
Hidrazoik asit sentezi için yöntemler
Çeşitli yöntemler hidrojen azidin sentezine izin verir.
Yaygın bir yaklaşım, sodyum azit (NaN3) ile sülfürik asit (H2SO4) veya hidroklorik asit (HCl) gibi bir asit arasındaki reaksiyonu içerir. Bu yöntemde asit, sodyum azid ile karışarak hidrojen azid ve kullanılan asidin karşılık gelen tuzunun oluşmasına neden olur.
Başka bir yöntem, sodyum azit ile metil iyodür (CH3I) veya etil iyodür (C2H5I) gibi bir alkil halojenür arasındaki reaksiyonu içerir. Curtius yeniden düzenlemesi olarak bilinen bu reaksiyon, ürün olarak hidrojen azit oluşumuyla sonuçlanır.
Sodyum azit ile nitröz asit (HNO2) arasındaki reaksiyon, hidrojen azit üretir. Yerinde nitröz asit üretmek için, tipik olarak asidik bir çözeltiye sodyum nitrit (NaNO2) eklenir. Sodyum azit ile nitröz asit arasındaki reaksiyon, hidrojen azit üretir.
Hidrojen azit sentezinin dikkatli kullanım ve uygun güvenlik önlemleri gerektirdiğini unutmamak önemlidir. Zehirliliği ve patlayıcı yapısı nedeniyle reaksiyonlar iyi havalandırılan bir alanda, uygun koruyucu ekipman kullanılarak ve belirlenmiş protokoller takip edilerek gerçekleştirilmelidir.
Her sentez yönteminin avantajları ve sınırlamaları vardır ve yöntemin seçimi, reaktifin mevcudiyeti, istenen verim ve güvenlik hususları gibi faktörlere bağlıdır. Tehlikeli kimyasalların işlenmesinde iyi bir anlayış ve uzmanlık, bu sentezlerin verimli ve güvenli bir şekilde gerçekleştirilmesi için esastır.
Hidrazoik Asitin Kullanım Alanları
Hidrojen azit benzersiz özelliklerinden dolayı çeşitli alanlarda uygulama alanı bulmaktadır. İşte bazı kullanımları:
- Kimyasal Reaktif: Hidrojen azit, organik sentezde çok yönlü bir kimyasal reaktif olarak görev yapar ve farmasötiklerde ve boyalarda önemli yapı taşları olan azitlerin sentezi de dahil olmak üzere birçok reaksiyona aktif olarak katılır.
- Patlatıcılar ve itici gazlar: Üreticiler, hava yastıklarında ve güvenlik cihazlarında kullanılan detonatörlerin ve itici gazların üretiminde hidrojen azit kullanıyor, patlayıcı yapısından ve nitrojen gazını aktif olarak serbest bırakan hızlı ayrışmasından yararlanarak bu uygulamalarda onu değerli kılıyor.
- Laboratuvar Analizi: Analitik kimya, çeşitli elementlerin ve bileşiklerin aktif tespiti ve belirlenmesi için hidrojen azit kullanır. Belirli metallerle aktif olarak kompleksler oluşturarak bunların kolorimetrik veya titrasyon yöntemleriyle ölçülmesine olanak tanır.
- Biyokimyasal Araştırma: Biyokimyasal araştırmalarda bilim adamları, biyomolekülleri değiştirmek ve işlevlerini incelemek için hidrojen azidi aktif olarak kullanırlar. Belirli fonksiyonel gruplarla seçici olarak reaksiyona girerek biyolojik moleküllerin tanımlanmasına ve karakterizasyonuna aktif olarak katkıda bulunur.
- Fotoğrafçılık: Geleneksel siyah beyaz fotoğrafçılıkta, hidrojen azit, emülsiyonlarda aktif olarak duyarlılaştırıcı olarak işlev görür, fotoğraf filmlerinin ışık hassasiyetini artırır ve aktif olarak daha iyi görüntü kalitesine yol açar.
- Korozyon Önleyici: Endüstriler, metaller, özellikle bakır ve alaşımları için korozyon önleyici olarak hidrojen azidi aktif olarak kullanıyor. Aktif olarak metal yüzeyinde koruyucu bir tabaka oluşturarak korozyonu aktif olarak önler ve çeşitli ekipman ve yapıların servis ömrünü uzatır.
- Gaz jeneratörleri: Hidrojen azit, hava yastıkları ve kurtarma sistemleri için gaz jeneratörlerinde aktif olarak rol oynar. Hızlı ayrışması aktif olarak nitrojen gazı açığa çıkararak şişirme ve açılma için gerekli kuvveti sağlar.
Sorular:
S: Hidrazoik asit kostik midir?
C: Evet, hidrazoik asit yakıcı olarak kabul edilir ve temas halinde yanıklara ve doku hasarına neden olabilir.
S: Hidrazoik asit güçlü bir asit midir?
C: Evet, hidrazoik asit, suda tamamen iyonlaşarak hidronyum iyonlarını serbest bırakabilen güçlü bir asit olarak sınıflandırılır.
S: Hidrazoik asit üçlü bir asit midir?
C: Hayır, hidrazoik asit üçlü bir asit değildir. Üçlü asitler üç farklı element (hidrojen, oksijen ve üçüncü bir element) içerirken, hidrazoik asit yalnızca hidrojen, nitrojen ve oksijen içerir.
S: 12,5 ml’de kaç ml hidrazoik asit var?
C: Soru eksik görünüyor ve doğru bir cevap için ek bilgi gerektiriyor.
S: Hidrazoik asit (HN3) için, varsa formal yükler de dahil olmak üzere doğru Lewis yapısı nedir?
C: HN3 için doğru Lewis yapısı, diğer üç nitrojen atomuna ve bir hidrojen atomuna bağlı merkezi bir nitrojen atomundan oluşur. Formal yükler elektronegatiflikteki farklılıklara göre belirlenebilir.
S: Hidrazoik asit sitokrom c oksidazı nasıl etkiler?
C: Hidrojen azit, hücresel solunumda rol oynayan bir enzim olan sitokrom c oksidazı aktif bölgesine bağlanarak ve fonksiyonunu bozarak inhibe eder.
Soru: 0,20 M hidrazoik asidin pH’ı 3,21 ise hidrazoik asidin Ka’sı nedir?
A: Hidrazoik asidin Ka’sı, pH ve Ka = [H3O+][A-]/[HA] denklemi kullanılarak hesaplanabilir. Ka değerini belirlemek için daha fazla bilgiye ihtiyaç vardır.
S: Hidrazoik asitteki (HN3) nitrojenin oksidasyon durumu nedir?
C: Hidrazoik asitteki nitrojenin oksidasyon durumu -1’dir.
S: Ka = 1,8 × 10^-9 ise 0,15 molar HN3 çözeltisinin pH’ı nedir?
C: 0,15 molarlık HN3 çözeltisinin pH’ı, Ka değeri ve pH = -log10(sqrt(Ka × [HA])) denklemi kullanılarak hesaplanabilir.
S: N2 + H2’yi HN3’e nasıl dengeleyebilirim?
C: N2 + H2 → HN3 reaksiyonunun dengeli denklemi 3N2 + 6H2 → 2HN3 olacaktır.
S: HN3’ün Ka’sı nasıl hesaplanır?
C: HN3’ün Ka’sı, HN3 ayrışma reaksiyonundaki ürünlerin ve reaktanların denge konsantrasyonu kullanılarak hesaplanabilir.
S: HN3’ün molaritesi 0,012 M ise NaN3’ün molaritesi nedir?
C: NaN3’ün molaritesi, ek bilgi olmadan veya NaN3 ile HN3 arasındaki reaksiyonun dengeli denklemi olmadan belirlenemez.
S: Hidrazoik asit (HN3) için, varsa formal yükler de dahil olmak üzere doğru Lewis yapısı nedir?
C: HN3 için doğru Lewis yapısı, diğer üç nitrojen atomuna ve bir hidrojen atomuna bağlı merkezi bir nitrojen atomu içerir. Formal yükler elektronegatiflikteki farklılıklara göre belirlenebilir.
