Formik asit veya HCOOH, keskin bir kokuya sahip renksiz bir sıvıdır. Koruyucu ve antibakteriyel madde olarak ve deri, tekstil ve kauçuk üretiminde yaygın olarak kullanılmaktadır.
| IUPAC Adı | Metanoik asit |
| Moleküler formül | HCOOH |
| CAS numarası | 64-18-6 |
| Eş anlamlı | Hidrojen karboksilik asit, formil asit, amino asit, formil asit, metakarbonik asit, tionil formik asit vb. |
| InChI | InChI=1S/CH2O2/c2-1-3/h1H,(H,2,3) |
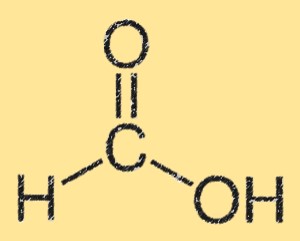
Formik asidin yapısı
Formik asidin yapısı, tek bir karbon atomuna bağlı bir karboksilik asit grubu (-COOH) ile karakterize edilir. Karbon atomu aynı zamanda bir hidrojen atomuna ve bir oksijen atomuna da bağlıdır. Formik asitin yapısı düzlemseldir ve karboksilik asit grupları arasında hidrojen bağları vardır. Hidrojen bağı sudaki yüksek çözünürlüğüne yol açar.
Formik Asit Formülü
Formik asitin kimyasal formülü HCOOH’dur. Bir karbon atomu, bir oksijen atomu ve iki hidrojen atomu içeren basit bir organik bileşiktir. Formik asidin formülü, kimyasal ve fiziksel özelliklerinin yanı sıra farklı koşullar altındaki davranışının belirlenmesinde önemlidir. Ayrıca stokiyometri ve molarite gibi çeşitli kimyasal hesaplamalarda da kullanılır.
Lewis yapısı HCOOH
Formik asidin (HCOOH) Lewis yapısı aşağıdaki gibidir:
H
|
C=O
|
AH
Karbon atomu dört değerlik elektronlu yapının merkezindedir. İki hidrojen atomu ve iki çift serbest elektrona sahip oksijen atomu ile tekli bağlar oluşturur. Oksijen atomu aynı zamanda bir çift serbest elektron taşıyan diğer karbon atomuyla da çift bağ oluşturur. Lewis yapısı, karbon ve oksijen atomları arasındaki elektronegatiflik farkından dolayı molekülün polar bir kovalent bağa sahip olduğunu gösterir.
Formik Asit Molar Kütlesi
Metanoik asit olarak da adlandırılan formik asidin molar kütlesi 46,03 g/mol’dür. Kimyasal formülü HCOOH’dur, bu da bir karbon atomu, bir oksijen ve iki hidrojen atomu içerdiğini gösterir. Molar kütle, belirli bir konsantrasyonda bir çözelti hazırlamak için gereken madde miktarının belirlenmesinde önemli bir parametredir. Örneğin 1 M formik asit çözeltisi hazırlamak için 46,03 g formik asidin 1 litre çözücü içinde çözülmesi gerekir.
Formik asitin kaynama noktası
HCOOH’nin kaynama noktası 100,8°C’dir (213,4°F). Keskin bir kokuya sahip, suda çok çözünür, renksiz bir sıvıdır. HCOOH’un kaynama noktası nispeten düşüktür, bu da kolayca buharlaştırılabileceği ve damıtılabileceği anlamına gelir. Bu özellik onu boya, plastik ve ilaç üretimi gibi çeşitli endüstriyel uygulamalarda faydalı kılar.
HCOOH Erime noktası
HCOOH’un erime noktası 8,4°C’dir (47,1°F). Oda sıcaklığında katıdır ve erime noktasının altına soğutularak saf haliyle elde edilebilir. HCOOH kristalleri beyazdır ve keskin bir koku yayarlar. HCOOH’un erime noktası diğer karboksilik asitlerle karşılaştırıldığında nispeten düşüktür, bu da onu belirli kimyasal reaksiyonlar için yararlı bir çözücü yapar.
HCOOH Yoğunluğu g/mL
HCOOH’nin yoğunluğu 25°C’de (77°F) 1.220 g/mL’dir. Aynı sıcaklıkta yoğunluğu 1000 g/mL olan sudan daha yoğundur. HCOOH’un yoğunluğu, su ve diğer çözücüler içindeki çözünürlüğünü belirleyen önemli bir özelliktir. Bu aynı zamanda sıcaklık ve basınç gibi farklı koşullar altındaki davranışını da etkiler.
Formik Asitin Molekül Ağırlığı
Formik asidin moleküler ağırlığı 46.03 g/mol’dür. HCOOH kimyasal formülüne sahip basit bir organik bileşiktir. Molekül ağırlığı, bir maddenin fiziksel ve kimyasal özelliklerinin belirlenmesinde önemli bir parametredir. Bir maddenin mol sayısı, kütlesi ve hacmi gibi çeşitli miktarları hesaplamak için kullanılır.
| Dış görünüş | Renksiz sıvı |
| Spesifik yer çekimi | 1.22 |
| Renk | Renksiz |
| Koku | Dönüm |
| Molar kütle | 46,03 gr/mol |
| Yoğunluk | 1.220 gr/ml |
| Füzyon noktası | 8,4°C |
| Kaynama noktası | 100,8°C |
| Flaş noktası | 68°C |
| sudaki çözünürlük | karışabilir |
| çözünürlük | Çoğu organik çözücüde çözünür |
| Buhar basıncı | 44,5 mmHg |
| Buhar yoğunluğu | 1,5 (hava=1) |
| pKa | 3.75 |
| pH | 2.4 |
Formik Asitin Güvenliği ve Tehlikeleri
HCOOH çeşitli güvenlik ve tehlike riskleri oluşturur. Temas halinde ciddi cilt yanıklarına ve göz hasarına neden olabilecek son derece aşındırıcı ve toksik bir maddedir. HCOOH buharlarının solunması solunum yolu tahrişine ve akciğer hasarına neden olabilir. Ayrıca yanıcıdır ve yüksek sıcaklıklarda tutuşarak yangın tehlikesi oluşturabilir. HCOOH ile çalışırken koruyucu kıyafet, eldiven ve göz koruması kullanımı da dahil olmak üzere uygun güvenlik önlemleri alınmalıdır. Oksitleyici maddeler ve alkaliler gibi uyumsuz malzemelerden uzakta, serin, kuru ve iyi havalandırılmış bir alanda saklanmalıdır.
| Tehlike sembolleri | Aşındırıcı, Toksik |
| Güvenlik Açıklaması | Koruyucu eldiven ve göz/yüz koruması kullanın. Göz ile teması halinde derhal bol su ile yıkayınız ve doktora başvurunuz. |
| BM kimlik numaraları | UN1779 |
| HS kodu | 2915.11.00 |
| Tehlike sınıfı | 8 (Aşındırıcı) |
| Paketleme grubu | II (Orta Seviye) |
| Toksisite | LD50 1,8 g/kg (ağızdan, sıçan) |
Formik asit sentezi için yöntemler
Formik asit çeşitli yöntemlerle sentezlenebilir.
- Yaygın bir yöntem, rodyum veya kobalt gibi bir katalizör varlığında karbon monoksit ve suyun reaksiyonunu içerir. Bu Formox sürecidir. Bu işlem formik asit ve hidrojen gazı üretir.
- Başka bir yöntem, asidik koşullar altında kromik asit veya potasyum permanganat gibi güçlü bir oksitleyici madde kullanılarak formaldehitin oksidasyonunu içerir. Bu reaksiyon formik asit ve su üretir.
- Formik asidi sentezlemenin bir yolu, sodyum formatı sülfürik asitle reaksiyona sokmaktır. Bu reaksiyon, yan ürün olarak formik asit ve sodyum sülfatın oluşmasıyla sonuçlanır.
- Karıncalar doğal savunma mekanizması olarak formik asit üretirler ve bu asit damıtma yoluyla vücutlarından elde edilebilir.
- HCOOH’yi sentezlemenin başka bir yöntemi, bakır kromit veya çinko oksit gibi bir katalizör varlığında karbondioksitin hidrojenle reaksiyona sokulmasını içerir. HCOOH sentez reaksiyonu olarak bilinen bu işlem, HCOOH ve su üretir.
- HCOOH, az miktarda bulunduğu ısırgan otu yaprakları gibi doğal kaynaklardan da elde edilebilir.
Genel olarak HCOOH sentezi için her birinin avantajları ve dezavantajları olan çeşitli yöntemler mevcuttur.
Formik Asitin Kullanım Alanları
Formik asitin çeşitli endüstrilerde geniş bir uygulama alanı vardır.
- Zararlı mikroorganizmaların büyümesini önleme yeteneği, formik asidin hayvan yemi ve silajda koruyucu ve antibakteriyel madde olarak yaygın bir seçim olmasını sağlar.
- Yem ve silajda zararlı mikroorganizmaların büyümesinin önlenmesine yardımcı olarak faydalı bir katkı maddesi haline gelir.
- Tekstil endüstrisi, renk haslığını iyileştirmek ve boyaların elyaflara afinitesini arttırmak için kumaş boyama ve terbiye maddesi olarak formik asit kullanır.
- Formik asit, asetik asit, formamid ve metanol gibi çeşitli kimyasalların üretiminde çözücü ve ara madde olarak görev yapar.
- Formik asit, deri endüstrisinde kullanılan, deri ürünlerinin dokusunu ve dayanıklılığını artırmaya yardımcı olan bir tabaklama maddesidir.
- Kauçuk üretiminde formik asit, pıhtılaştırıcı görevi görerek vulkanizasyon sürecine yardımcı olur.
- İlaç endüstrisi formik asidi aşılarda koruyucu ve tıbbi ekipmanlarda dezenfektan olarak kullanıyor.
- Ek olarak formik asit, diüretikler ve antihistaminikler dahil olmak üzere çeşitli ilaçların üretiminde de uygulama alanı bulur.
- Formik asit, organik sentez reaksiyonlarında indirgeyici bir madde ve polimerizasyon reaksiyonlarında bir katalizördür.
- Formik asit, çeşitli ürünlerin aromasını artırmaya yardımcı olarak aroma ve koku üretiminde faydalı olmasını sağlar.
Genel olarak formik asitin çeşitli endüstrilerdeki uygulamalarının çeşitliliği, benzersiz özelliklerinden ve çok yönlü yapısından kaynaklanmaktadır.
Sorular:
S. Formik asit güçlü bir asit midir?
A. Formik asit, pKa değeri yaklaşık 3,75 olan zayıf bir asittir. Bu, suda tamamen ayrışmadığı ve hidroklorik asit veya sülfürik asit gibi güçlü asitlerden daha zayıf bir asit olduğu anlamına gelir.
S. Hangisi daha asidik formik asit veya asetik asittir?
A. Formik asit, asetik asitten daha asidiktir. Bunun nedeni asetik asitte konjuge bazındaki negatif yükü stabilize eden ve ayrışma olasılığını azaltan bir metil grubunun varlığıdır. Öte yandan formik asit daha küçük bir moleküler boyuta ve daha güçlü bir elektronegatif atoma (oksijen) sahiptir, bu da ayrışmayı kolaylaştırır ve onu daha asidik hale getirir.
Soru: Formik asit hangi karınca tarafından üretilir?
C. Formik asit, odun karıncaları, ateş karıncaları ve bazı iğnesiz arı türleri de dahil olmak üzere çeşitli karınca türleri tarafından üretilir. Asit, karıncanın vücudunda depolanır ve yırtıcı hayvanlara karşı bir savunma mekanizması olarak kullanılır. Karınca tehdit edildiğinde formik asidi iğnesinden fırlatabilir veya vücudundaki özel bezlerden salgılayabilir.
