Fosforik asit (H3PO4) renksiz ve kokusuz bir mineral asittir. Yiyecek ve içecek endüstrisinde tatlandırıcı madde olarak ve otomobil endüstrisinde pas önleyici olarak yaygın olarak kullanılmaktadır.
| IUPAC Adı | Fosforik asit |
| Moleküler formül | H3PO4 |
| CAS numarası | 7664-38-2 |
| Eş anlamlı | Ortofosforik asit, trihidroksidooksidofosfor, fosforik asit (V), ortofosforik asit, berrak fosforik asit teknolojisi, fosforaeur |
| InChI | InChI=1S/H3O4P/c1-5(2,3)4/h(H3,1,2,3,4) |
Fosforik asidin özellikleri
Fosforik asidin molar kütlesi
Fosforik asidin molar kütlesi 98.00 g/mol’dür. Bu değer, molekülü oluşturan atomların her birinin (bir fosfor atomu ve üç oksijen atomu) atomik kütlelerinin eklenmesiyle hesaplanır. Molar kütle bir bileşiğin önemli bir özelliğidir çünkü Avogadro sayısını kullanarak belirli bir numunede bulunan madde miktarını hesaplamak için kullanılır. Ek olarak fosforik asidin molar kütlesi, bir çözeltinin konsantrasyonunu titrasyon yoluyla belirlemek için kullanılır.
Fosforik Asit Formülü
Fosforik asidin kimyasal formülü H3PO4’tür; bu, onun bir fosfor atomu, üç hidrojen atomu ve dört oksijen atomu içerdiğini gösterir. Bir baza üçe kadar hidrojen iyonu verebilen zayıf bir asittir. Formül önemlidir çünkü kimyasal denklemler yazmamıza ve fosforik asit içeren kimyasal reaksiyonların stokiyometrisini hesaplamamıza olanak tanır. Ek olarak formül, bir fosforik asit çözeltisinin konsantrasyonunu titrasyon yoluyla hesaplamak için kullanılır.
Fosforik asidin kaynama noktası
Fosforik asidin kaynama noktası 1 atmosfer basınçta 158°C’dir (316°F). Bu, bu sıcaklık ve basınçta fosforik asidin sıvı fazının gaz fazına dönüşeceği anlamına gelir. Kaynama noktası bileşikte mevcut olan moleküller arası kuvvetlere bağlıdır ve fosforik asit durumunda moleküller arasındaki hidrojen bağlarının varlığına bağlıdır. Kaynama noktası bir bileşiğin önemli bir fiziksel özelliğidir çünkü birçok endüstriyel proseste yararlı olan uçuculuğunu belirlemek için kullanılır.
Fosforik asidin erime noktası
Fosforik asidin erime noktası 42,35°C’dir (108,23°F). Bu, fosforik asidin katı fazının sıvı faza dönüşeceği sıcaklıktır. Erime noktası bileşikte mevcut olan moleküller arası kuvvetlerin gücüne bağlıdır ve fosforik asit durumunda moleküller arasındaki hidrojen bağlarının varlığına bağlıdır. Erime noktası bir bileşiğin önemli bir fiziksel özelliğidir çünkü saflığını belirlemek ve kimliğini oluşturmak için kullanılır.
Fosforik asit yoğunluğu g/ml
Fosforik asidin yoğunluğu oda sıcaklığında (25°C veya 77°F) 1.685 g/ml’dir. Bu birim hacim başına maddenin kütlesidir. Yoğunluk bir maddenin fiziksel bir özelliğidir ve belirli bir madde kütlesinin hacmini veya belirli bir madde hacminin kütlesini hesaplamak için kullanılır. Fosforik asitin yoğunluğu gübre, deterjan ve gıda katkı maddelerinin üretimi de dahil olmak üzere birçok endüstriyel proseste önemlidir.
Fosforik Asitin Molekül Ağırlığı
Fosforik asidin moleküler ağırlığı 98.00 g/mol’dür. Moleküldeki tüm atomların atom ağırlıklarının toplamıdır. Molekül ağırlığı bir bileşiğin önemli bir özelliğidir çünkü belirli bir numunede bulunan madde miktarını hesaplamak için kullanılır. Ek olarak fosforik asidin moleküler ağırlığı, titrasyon yoluyla bir çözeltinin konsantrasyonunu belirlemek için kullanılır.
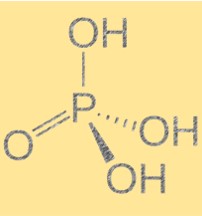
Fosforik asitin yapısı (H3PO4)
Fosforik asit, H3PO4 moleküler formülüne ve tetrahedral moleküler geometriye sahiptir. Triprotik bir asittir, yani bir baza üç hidrojen iyonu bağışlayabilir. Molekül, üçü hidrojen atomuna bağlı dört oksijen atomuna bağlı bir fosfor atomu içerir. Fosforik asidin yapısı önemlidir çünkü kimyasal ve fiziksel özelliklerini belirler. Moleküller arasında hidrojen bağlarının varlığı, yüksek kaynama ve erime noktalarına yol açar.
| Dış görünüş | Renksiz sıvı |
| Spesifik yer çekimi | 25°C’de 1,685 |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 98,00 gr/mol |
| Yoğunluk | 25°C’de 1,685 g/ml |
| Füzyon noktası | 42,35°C (108,23°F) |
| Kaynama noktası | 1 atm basınçta 158°C (316°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Suda tamamen çözünür |
| çözünürlük | Etanol, dietil eter ve asetonda çözünür |
| Buhar basıncı | 20°C’de 0,0002 mmHg |
| Buhar yoğunluğu | 3,5 (hava = 1) |
| pKa | pKa1=2,148, pKa2=7,198, pKa3=12,319 |
| pH | 1,0 – 2,5 (konsantre çözelti), 2,8 – 3,2 (seyreltilmiş çözelti) |
H3PO4 Güvenlik ve tehlikeler
Fosforik asit çeşitli güvenlik riskleri taşır ve dikkatle kullanılmalıdır. Ciddi cilt ve göz tahrişine neden olabilir ve metallere karşı çok aşındırıcıdır. Cilt, göz veya mukoza ile doğrudan temas ciddi yanıklara ve hatta kalıcı hasara neden olabilir. Dumanların solunması solunum yollarında tahrişe ve yanıklara neden olabilir. Ciddi iç yanıklara ve gastrointestinal rahatsızlığa neden olabileceğinden yutulmamalıdır. Fosforik asitle çalışırken eldiven, gözlük ve solunum cihazı gibi uygun kişisel koruyucu ekipmanlar giyilmelidir. Ayrıca oksitleyici maddeler ve alkaliler gibi uyumsuz malzemelerden uzakta, serin ve kuru bir yerde saklanmalıdır.
| Tehlike sembolleri | Aşındırıcı |
| Güvenlik Açıklaması | Kabı sıkıca kapalı tutun. Koruyucu eldiven/koruyucu kıyafet/göz koruyucu/yüz koruyucu kullanın. |
| BM kimlik numaraları | UN1805 |
| HS kodu | 280920 |
| Tehlike sınıfı | 8 (Aşındırıcı maddeler) |
| Paketleme grubu | II (orta tehlike) |
| Toksisite | Oral LD50 (sıçan) – 1533 mg/kg |
H3PO4 sentez yöntemleri
Fosforik asitin (H3PO4) sentezlenmesi için çeşitli yöntemler mevcuttur.
En yaygın yöntem, kaya fosfatının sülfürik asitle reaksiyonunu içeren ıslak işlemdir. Kalsiyum sülfat (alçıtaşı) ve H3PO4 üretmek için fosfat kayası önce ezilir ve ardından konsantre sülfürik asitle karıştırılır. Ortaya çıkan süspansiyonun filtrelenmesinden sonra, bir dizi solvent ekstraksiyonu ve çökeltme adımları H3PO4’ü saflaştırır.
H3PO4’ü sentezlemenin başka bir yöntemi, H3PO4 ve elementel fosfor ve kalsiyum oksit gibi diğer yan ürünleri üretmek için fosfat kayasının yüksek sıcaklığa ısıtılmasını içeren termal işlemdir. Bu yöntem, yüksek enerji gereksinimleri nedeniyle ıslak işleme göre daha az yaygındır.
Fosfor pentoksitin suyla reaksiyonu H3PO4’ü sentezler. Elektronik ve yarı iletken endüstrileri genellikle bu yöntemi yüksek saflıkta H3PO4 üretmek için kullanır.
H3PO4’ü sentezlemenin diğer yöntemleri arasında fosforun elektrokimyasal oksidasyonu, fosfor triklorürün hidrolizi ve fosforun nitrik asitle reaksiyonu yer alır. Bu yöntemler, yüksek maliyetleri ve karmaşıklıkları nedeniyle ıslak ve termal işlemlere göre daha az yaygındır.
H3PO4’ün Kullanım Alanları
Fosforik asit, çeşitli endüstrilerde geniş bir uygulama alanına sahip çok yönlü bir bileşiktir. Başlıca kullanımlarından bazıları şunlardır:
- Gübre üretimi: diamonyum fosfat ve üçlü süperfosfat gibi gübre üretiminin ana bileşeni.
- Yiyecek ve içecek endüstrisi: Kola içecekleri, reçeller ve işlenmiş peynir gibi çeşitli yiyecek ve içecek ürünlerinde gıda katkı maddesi ve aroma maddesi olarak kullanılır.
- Endüstriyel Temizlik: Pas ve diğer mineral birikintilerini çözebilme özelliğinden dolayı sanayi sektöründe temizleyici ve pas sökücü olarak kullanılır.
- Su Arıtma: Endüstriyel proseslerde suyun pH seviyelerini kontrol etmek ve ayrıca ağır metalleri ve diğer yabancı maddeleri uzaklaştırmak için kullanılır.
- Farmasötikler: PH seviyelerini düzenleme özelliğinden dolayı farmasötiklerin ve besin takviyelerinin üretiminde kullanılır.
- Diş Hekimliği: Kök kanal tedavisi gibi diş prosedürlerinde ve diş çimentosunun bir bileşeni olarak kullanılır.
- Metal İşleme: Paslanmaz çelik, alüminyum ve titanyum gibi metallerin korozyon direncini arttırmak için işlemek ve pasifleştirmek için kullanılır.
- Elektronik: Elektronik endüstrisinde temizlik maddesi olarak ve yarı iletken üretiminde bileşen olarak kullanılır.
Sorular:
Soru: Fosforik asidin formülü nedir?
A: Fosforik asidin formülü H3PO4’tür.
S: H3PO4 güçlü bir asit midir?
C: Hayır, H3PO4 güçlü bir asit olarak kabul edilmez. pKa değeri 2,15 olan zayıf bir asittir.
Soru: H3PO4 asit mi baz mı?
C: H3PO4 bir asittir çünkü suda çözündüğünde bir proton (H+) verir.
S: H3PO4’ün Lewis yapısı nedir?
C: H3PO4 için Lewis yapısı, dört oksijen atomu ile çevrelenmiş merkezi bir fosfor atomuna sahip dört yüzlü bir yapıdır. Her oksijen atomu, fosfor atomuyla tek bir bağ oluşturur ve ayrıca her oksijen atomunda üç çift yalnız elektron bulunur.
Soru: Fosforik asit güçlü bir asit midir? C: Hayır, fosforik asit güçlü bir asit olarak kabul edilmez. İlk proton bağışında pKa değeri 2,15, ikinci proton bağışında ise 7,20 olan zayıf bir asittir.
