Fosfor triklorür, fosfor ve üç klor atomundan oluşan kimyasal bir bileşiktir. Yaygın olarak kimyasal reaksiyonlarda reaktif olarak ve organofosfor bileşiklerinin öncüsü olarak kullanılır.
| IUPAC Adı | Fosfor triklorür |
| Moleküler formül | PCl3 |
| CAS numarası | 7719-12-2 |
| Eş anlamlı | Triklorofosfin, fosfor klorür, fosfor triklorür, fosfor (III) klorür |
| InChI | InChI=1S/Cl3P/c1-4(2)3 |
Fosfor triklorürün özellikleri
Fosfor Triklorür Formülü
Fosfor triklorürün formülü PCl3’tür. Üç klor atomuna bağlı bir fosfor atomundan oluşur. Bu kimyasal bileşik, reaktivitesi ve çok yönlülüğü nedeniyle çeşitli endüstrilerde ve laboratuvarlarda yaygın olarak kullanılmaktadır.
Fosfor Triklorür Molar Kütlesi
Triklorofosfinin molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanabilir. Fosforun atom kütlesi mol başına yaklaşık 31,0 gram, klorun ise mol başına yaklaşık 35,5 gram atomik kütlesi vardır. Bu nedenle PCl3’ün molar kütlesi mol başına yaklaşık 137,3 gramdır.
Fosfor triklorürün kaynama noktası
Triklorofosfinin kaynama noktası yaklaşık 76,1 santigrat derecedir. Bu, ısıtıldığında sıvıdan gaza dönüştüğü anlamına gelir. Kaynama noktası, çeşitli kimyasal reaksiyonlarda ve işlemlerde triklorofosfin kullanılırken ve kullanılırken dikkate alınması gereken önemli bir özelliktir.
Fosfor triklorür Erime noktası
Triklorofosfinin erime noktası yaklaşık -112,7 santigrat derecedir. Bu sıcaklıkta katıdan sıvıya faz geçişine uğrar. Erime noktası, farklı koşullar altında triklorofosfinin fiziksel durumunu belirlemek için çok önemli bir özelliktir.
Fosfor triklorürün yoğunluğu g/mL
Triklorofosfinin yoğunluğu mililitre başına yaklaşık 1.574 gramdır. Yoğunluk, bir maddenin birim hacim başına kütlesini temsil eder ve malzemenin kompaktlığı ve ağırlığı hakkında fikir verir. Triklorofosfinin yoğunluğu genellikle kimyasal hesaplamalarda ve formülasyonlarda kullanılır.
Fosfor Triklorür Molekül Ağırlığı
Triklorofosfinin molekül ağırlığı, bileşenlerinin atom ağırlıkları eklenerek hesaplandığında, mol başına yaklaşık 137,3 gramdır. Molekül ağırlığı, kimyasal reaksiyonlarda madde miktarının belirlenmesi ve hassas ölçümlerin formüle edilmesi için değerli bir parametredir.
Fosfor triklorürün yapısı
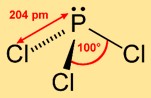
Triklorofosfin, fosfor atomunun tepeyi işgal ettiği ve üç klor atomunun üçgen bir taban oluşturduğu trigonal bir piramit yapısını benimser. Bu moleküler düzenleme kimyasal reaktivitesine katkıda bulunur ve çeşitli reaksiyonlardaki davranışını etkiler.
Fosfor triklorürün çözünürlüğü
Triklorofosfin suda çok az çözünür, ancak benzen ve karbon tetraklorür gibi organik çözücülerde kolaylıkla çözünür. Triklorofosfinin çözünürlük özellikleri, farklı kimyasal işlemlerde ve uygulamalarda kullanımı için uygun çözücülerin belirlenmesinde önemli hususlardır.
| Dış görünüş | Renksiz veya soluk sarı sıvı |
| Spesifik yer çekimi | 1.574 g/mL |
| Renk | Renksiz |
| Koku | Dönüm |
| Molar kütle | 137,3 g/mol |
| Yoğunluk | 1.574 g/mL |
| Füzyon noktası | -112,7°C |
| Kaynama noktası | 76,1°C |
| Flaş noktası | Uygulanamaz (Yanıcı değildir) |
| sudaki çözünürlük | Suyla reaksiyona girer |
| çözünürlük | Benzen ve karbon tetraklorür gibi organik çözücülerde çözünür |
| Buhar basıncı | 25°C’de 105 mmHg |
| Buhar yoğunluğu | 4,83 (Hava = 1) |
| pKa | Uygulanamaz |
| pH | Asit (pH < 7) |
Fosfor triklorürün güvenliği ve tehlikeleri
Triklorofosfin çeşitli güvenlik riskleri oluşturur ve dikkatli kullanılmalıdır. Cilt, gözler ve solunum sistemi için oldukça aşındırıcıdır. Doğrudan temas ciddi yanıklara ve göz hasarına neden olabilir. Buharlarının solunması solunum yolu tahrişine ve akciğer hasarına neden olabilir. Ek olarak triklorofosfin suyla şiddetli reaksiyona girerek toksik hidroklorik asit buharları açığa çıkarır. Belirli koşullar altında yanıcıdır ve oksitleyici maddelerle teması yangına veya patlamaya neden olabilir. Bu kimyasalla çalışırken eldiven, gözlük ve solunum cihazı gibi yeterli kişisel koruyucu ekipman kullanılmalıdır. Riskleri en aza indirmek için yeterli havalandırma ve uyumsuz maddelerden uzakta depolama çok önemlidir.
| Tehlike sembolleri | Aşındırıcı, Toksik |
| Güvenlik Açıklaması | – Ciddi cilt yanıklarına ve göz hasarına neden olur – Yutulması, solunması veya emilmesi halinde zararlıdır – Suyla şiddetli reaksiyona girerek zehirli dumanlar çıkarır – Belirli koşullar altında yanıcıdır |
| Birleşmiş Milletler tanımlayıcıları | UN1809 |
| HS kodu | 2812.10.00 |
| Tehlike sınıfı | 8 (Aşındırıcı), 6.1 (Zehirli) |
| Paketleme grubu | II |
| Toksisite | Çok zehirli |
Fosfor triklorür sentez yöntemleri
Triklorofosfin çeşitli yöntemlerle sentezlenir. Yaygın bir yaklaşım, fosforun aşırı klor gazı ile ısıtılması, triklorofosfin oluşumuna yol açmaktır.
Başka bir yöntem, triklorofosfin üretmek için fosfor pentaklorürün (PCl5) triklorofosfin (PCl3) ile ısıtılmasını içerir.
Fosfor oksit (P2O5) ile hidroklorik asit (HCl) arasındaki reaksiyon, triklorofosfinin sentezini kolaylaştırmak için iki maddeyi genellikle bir geri akış kondansatörüyle birleştirir.
Ek olarak fosfor tribromürün (PBr3) triklorofosfin ile ısıtılması triklorofosfin üretimiyle sonuçlanır.
Triklorofosfinin sentezinin, reaktif ve tehlikeli maddelerin işlenmesini gerektirdiğinden, uygun güvenlik önlemleriyle gerçekleştirilmesi gerektiğine dikkat etmek önemlidir. Uygun koruyucu ekipman kullanarak ve iyi havalandırılmış laboratuvar koşullarını sağlayarak sentez işlemi sırasında güvenliği sağlayın.
Genel olarak, bu farklı sentetik yöntemler triklorofosfinin elde edilmesine yönelik farklı yaklaşımlar sunmakta ve böylece geniş bir yelpazedeki endüstriyel ve araştırma uygulamaları için üretiminde esneklik sağlamaktadır.
Fosfor Triklorürün Kullanım Alanları
Triklorofosfin, çok yönlü doğası ve reaktivitesi nedeniyle çeşitli uygulamalarda yaygın olarak kullanılmaktadır. İşte bazı temel kullanımlar:
- Kimyasal reaktif: Organik sentezlerde, özellikle organofosfor bileşiklerinin üretiminde önemli bir reaktif görevi görür. Vilsmeier-Haack reaksiyonu ve Pudovik reaksiyonu gibi reaksiyonlara katılır.
- Katalizör: Triklorofosfin, farmasötiklerin, boyaların ve pestisitlerin sentezi dahil olmak üzere çeşitli kimyasal reaksiyonlarda katalizör görevi görür.
- Fosfor Kaynağı: Fosfor asit ve fosfor oksiklorür gibi fosfor bazlı kimyasalların üretiminde fosfor kaynağı olarak görev yapar.
- Alev Geciktirici: Üreticiler polimerlere alev geciktirici olarak triklorofosfin ekleyerek yanıcılığı azaltmaya ve malzemelerin yangın güvenliğini artırmaya yardımcı olur.
- Kimyasal ara madde: Farmasötikler, herbisitler, böcek öldürücüler ve plastikleştiriciler dahil olmak üzere çeşitli kimyasallar, önemli bir ara madde olarak triklorofosfin kullanılarak üretilir.
- Laboratuvar Reaktifi: Laboratuvarlar, asil klorürlerin oluşumu ve alkollerin alkil klorürlere dönüştürülmesi de dahil olmak üzere kimyasal reaksiyonlar için çok yönlü bir reaktif olarak triklorofosfini yaygın olarak kullanır.
- Su Arıtma: Triklorofosfinin güçlü oksitleyici ve klorlayıcı özellikleri, onu su arıtma proseslerinde değerli bir bileşen haline getirir ve yabancı maddeleri ve kirletici maddeleri etkili bir şekilde giderir.
- Farmasötikler: Triklorofosfin, kanser, iltihaplanma ve nörolojik bozuklukların tedavisine yönelik ilaçlar da dahil olmak üzere farmasötik bileşiklerin sentezinde rol oynar.
- Tarımsal uygulamalar: Belirli pestisitlerin ve herbisitlerin bir bileşeni olarak tarımda uygulama alanı bulur, böylece mahsulün korunmasına ve yabani ot kontrolüne katkıda bulunur.
- Plastik üretimi: Üreticiler, malzeme özelliklerini geliştirmek ve alev geciktirici hale getirmek için plastik ve polimer katkı maddelerinin üretiminde triklorofosfin kullanıyor.
Bu çeşitli uygulamalar, triklorofosfinin çeşitli endüstrilerde, araştırmalarda ve günlük uygulamalardaki önemini vurgulamaktadır.
Sorular:
S: Fosfor triklorür baz mı yoksa asit mi?
C: Triklorofosfin bir asittir.
S: Bir fosfor triklorür (PCl3) molekülünde kaç tane klor atomu vardır?
Cevap: Bir triklorofosfin molekülünde üç klor atomu vardır.
Soru: 200 g fosfor triklorürün reaksiyona girdiği bir reaksiyonun yüzde verimi nedir?
C: Elde edilen ürün miktarı bilgisi olmadan verim yüzdesi belirlenemez.
Soru: 15 gram fosfor triklorürde kaç mol vardır?
C: 15 gramda yaklaşık 0,116 mol triklorofosfin bulunur.
S: İkili moleküler bileşik fosfor triklorürü hangi formül temsil eder?
C: PCl3 formülü triklorofosfin anlamına gelir.
S: Fosfor triklorürün formülü nedir?
C: Fosfor triklorürün formülü PCl3’tür.
S: Fosfor triklorür iyonik mi yoksa kovalent mi?
C: Triklorofosfin kovalent bir bileşiktir.
S: Bir fosfor triklorür (PCl3) molekülünde kaç tane klor atomu vardır?
Cevap: Bir triklorofosfin molekülünde üç klor atomu vardır.
S: Triklorofosfinin Lewis yapısı?
C: Triklorofosfinin Lewis yapısı, fosfor atomunda yalnız çiftler bulunan, üç klor atomuna bağlı merkezi bir fosfor atomuna sahiptir.
S: Fosfor (P4) (s) + Klor (g) → Triklorofosfin (l)?
C: Dengeli denklem katı fosfor (P4) ile klor gazı (Cl2) arasındaki reaksiyonu temsil ederek sıvı PCl3’ü oluşturur.
S: Fosfor triklorürün formu nedir?
C: Triklorofosfin, fosfor atomunda bir çift serbest elektronun varlığından dolayı trigonal piramit şekline sahiptir.
S: Fosfor triklorür iyonik bir bileşik midir?
C: Hayır, triklorofosfin iyonik bir bileşik değildir; kovalent bir bileşiktir.
S: Fosfor triklorürün yansıma düzlemleri var mı?
C: Hayır, triklorofosfinin yansıma düzlemleri yoktur.
