Fosfor pentasülfür (P2S5), iki fosfor atomu ve beş kükürt atomundan oluşan bir bileşiktir. Böcek ilacı ve yağlayıcıların üretimi de dahil olmak üzere çeşitli uygulamalarda kullanılır.
| IUPAC Adı | Fosfor pentasülfür |
| Moleküler formül | P2S5 |
| CAS numarası | 1314-80-3 |
| Eş anlamlı | Fosfor (V) sülfür; Difosfor pentasülfür; Fosforik sülfür; Pentasülfürlenmiş fosfor |
| InChI | InChI=1S/2P.5S |
Fosfor pentasülfürün özellikleri
Fosfor pentasülfür formülü
Fosfor pentasülfürün formülü P2S5’tir. Beş kükürt atomuna bağlı iki fosfor atomundan oluşur.
Fosfor Pentasülfür Molar Kütlesi
Difosfor pentasülfürün molar kütlesi, kurucu elementlerin atomik kütlelerinin eklenmesiyle hesaplanabilir. Fosforun (P) atom kütlesi yaklaşık 30,97 g/mol ve kükürtün (S) atomik kütlesi yaklaşık 32,07 g/mol’dür. Bu nedenle P2S5’in molar kütlesi yaklaşık 222,27 g/mol’dür.
Fosfor pentasülfürün kaynama noktası
Difosfor pentasülfürün kaynama noktası yaklaşık 514 santigrat derece (957 Fahrenheit derece)’dir. Bu sıcaklıkta bileşik sıvıdan gaza faz geçişine uğrar.
Fosfor pentasülfür Erime noktası
Difosfor pentasülfürün erime noktası yaklaşık 280 santigrat derecedir (536 Fahrenheit derece). Bu, bileşiğin katı halden sıvı duruma geçtiği sıcaklıktır.
Fosfor pentasülfitin yoğunluğu g/mL
Difosfor pentasülfürün yoğunluğu yaklaşık 2,02 g/mL’dir. Bu, bileşiğin nispeten yoğun olduğunu ve birim hacim başına yüksek kütleye sahip olduğunu gösterir.
Fosfor Pentasülfit Molekül Ağırlığı
Kendisini oluşturan elementlerin atom ağırlıklarının toplamı olan difosfor pentasülfürün moleküler ağırlığı yaklaşık 222,27 g/mol’dür.
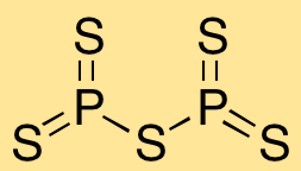
Fosfor pentasülfürün yapısı
Difosfor pentasülfür, iki fosfor atomunun beş kükürt atomuna bağlandığı moleküler bir yapıya sahiptir. Atomların düzeni, merkezde fosfor atomları ve onları çevreleyen kükürt atomları ile trigonal iki piramidal bir şekil oluşturur.
Fosfor pentasülfürün çözünürlüğü
Difosfor pentasülfür suda çok az çözünür, bu da yalnızca sınırlı ölçüde çözündüğü anlamına gelir. Ancak benzen ve karbon disülfit gibi organik çözücülerde daha fazla çözünür.
| Dış görünüş | Sarı katı |
| Spesifik yer çekimi | 2.02 |
| Renk | SARI |
| Koku | Keskin koku |
| Molar kütle | 222,27 gr/mol |
| Yoğunluk | 2,02g/ml |
| Füzyon noktası | 280°C (536°F) |
| Kaynama noktası | 514°C (957°F) |
| Flaş noktası | Müsait değil |
| sudaki çözünürlük | Az çözünür |
| çözünürlük | Benzen ve karbon disülfür gibi organik çözücülerde çözünür |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | Müsait değil |
| pH | Müsait değil |
Fosfor pentasülfürün güvenliği ve tehlikeleri
Difosfor pentasülfür çeşitli güvenlik riskleri taşır ve kullanılırken dikkatli olunmalıdır. Temas veya solunması halinde ciltte, gözlerde ve solunum sisteminde ciddi tahrişlere ve yanıklara neden olabilir. Bileşikle doğrudan temastan kaçınılmalı ve koruyucu eldiven, gözlük ve solunum ekipmanı kullanılmalıdır. Aynı zamanda yanıcıdır ve ısıya veya aleve maruz kaldığında tutuşarak toksik kükürt oksitler üretebilir. Ateşleme kaynaklarından uzakta uygun şekilde saklanması gereklidir. Ayrıca difosfor pentasülfür yanıcı veya toksik gazlar oluşturabileceğinden su veya reaktif maddelerle karıştırılmamalıdır. Bu bileşikle çalışırken uygun havalandırma ve güvenlik protokollerine bağlılık çok önemlidir.
| Tehlike sembolleri | Yanıcı, Tahriş Edici |
| Güvenlik Açıklaması | Ciddi cilt yanıklarına ve göz hasarına neden olur. Solunması halinde zararlıdır. Yanıcı katı. |
| BM kimlik numaraları | BM 1340 |
| HS kodu | 2812120000 |
| Tehlike sınıfı | 4,2 (yanıcı katı), 8 (aşındırıcı) |
| Paketleme grubu | II |
| Toksisite | Zehirli |
Fosfor pentasülfürün sentezi için yöntemler
Difosfor pentasülfürü sentezlemek için farklı yöntemler kullanılabilir.
Difosfor pentasülfürün sentezlenmesine yönelik yaygın bir yöntem, elementel fosfor ve kükürtün kontrollü bir ortamda, genellikle kapalı bir kapta birlikte ısıtılmasını içerir. Yüksek sıcaklık reaksiyonu kolaylaştırır ve difosfor pentasülfit oluşumuna yol açar.
Başka bir yöntem, fosfor trisülfürün (P4S3) fazla kükürt ile karıştırılmasını ve reaksiyonun desteklenmesi için karışımın ısıtılmasını içerir. Fazla kükürt, fosfor trisülfit ile birleşerek difosfor pentasülfit üretimine neden olur.
Fosfor pentaklorürün (PCl5) hidrojen sülfür (H2S) ile karbon disülfür gibi uygun bir çözücünün varlığında reaksiyonu, difosfor pentasülfürün hazırlanmasına olanak sağlar. Reaksiyon difosfor pentasülfür üretir ve yan ürün olarak hidrojen klorür (HCl) gazı açığa çıkarır.
İlgili reaktiflerin ve ürünlerin tehlikeli yapısından dolayı bu sentetik yöntemleri kullanırken lütfen dikkatli olun. Sentez işlemi sırasında uygun koruyucu ekipman kullanmak ve iyi havalandırılan alanlarda çalışmak gibi uygun güvenlik önlemlerini alın.
Fosfor Pentasülfürün Kullanım Alanları
Difosfor pentasülfür, benzersiz özellikleri nedeniyle çeşitli endüstrilerde ve işlemlerde uygulama alanı bulur. İşte bazı kullanımları:
- Böcek ilacı üretimi: Üreticiler, özellikle sivrisinek ve keneler gibi zararlıları kontrol etmeyi amaçlayan böcek ilaçlarının üretiminde önemli bir bileşen olarak difosfor pentasülfidi kullanıyor.
- Yağlayıcı katkı maddesi: Şirketler, aşırı basınç ve aşınma önleme özelliklerini geliştirmek için yağlayıcılara katkı maddesi olarak difosfor pentasülfür ekler. Bu katkı maddesi yağlama performansını artırır ve makineleri yüksek stres koşullarında korur.
- Kimyasal sentez: Difosfor pentasülfür, organik sentezde yaygın olarak kullanılan tiyonil klorürün (SOCl2) sentezi gibi çeşitli kimyasal reaksiyonlarda reaktif olarak görev yapar.
- İlaç endüstrisi: İlaç endüstrisi, belirli bileşikleri ve ara ürünleri sentezlemek için araştırma ve geliştirme süreçlerinde difosfor pentasülfür kullanır.
- Metal ekstraksiyonu: Metalurjik işlemlerde, bazı metalleri, özellikle bakır ve çinkoyu cevherlerinden çıkarmak için difosfor pentasülfür kullanılır. Kirliliğin giderilmesine yardımcı olur ve metallerin saflaştırılmasını kolaylaştırır.
- Boyaların ve pigmentlerin üretimi: Difosfor pentasülfür, çeşitli boyaların ve pigmentlerin sentezinde rol oynar ve kimyasal yapıları için önemli bir yapı taşı görevi görür.
- Kimyasal Savaş Ajanları: Tarihsel olarak difosfor pentasülfür, kimyasal savaş ajanlarının üretiminde kullanılmıştır. Ancak uluslararası anlaşmalar bu amaçlarla kullanımını sıkı bir şekilde düzenlemekte ve kontrol etmektedir.
Difosfor pentasülfürün tehlikeli doğasından dolayı, kullanılırken, saklanırken ve imha edilirken uygun güvenlik önlemlerine ve protokollere uyulması gerektiğine dikkat etmek önemlidir.
Sorular:
S: Fosfor pentasülfür dimer nedir?
C: Difosfor pentasülfür dimer, kimyasal olarak birbirine bağlanmış iki fosfor pentasülfür molekülünün moleküler yapısını ifade eder.
S: Fosfor pentasülfürün entropisi nedir?
C: Difosfor pentasülfürün entropisi, belirli bir sıcaklıkta moleküler düzensizliğinin veya rastgeleliğinin ölçülmesini ifade eder.
S: Fosfor pentasülfürün entalpisi nedir?
C: Difosfor pentasülfürün entalpisi, kimyasal reaksiyonları veya dönüşümleriyle ilişkili ısı içeriğini veya enerji değişimini ifade eder.
S: P2S5 nedir?
C: P2S5, beş kükürt atomuna bağlı iki fosfor atomundan oluşan bir bileşik olan difosfor pentasülfürün moleküler formülüdür.
S: 45,0 g P2S5’te kaç gram kükürt var?
C: 45,0 g P2S5 yaklaşık 28,13 g kükürt içerir.
S: 222 gram üretmek için kaç tane P2S5 molekülüne ihtiyacınız var?
C: 222 grama eşit olmak için yaklaşık 1,54 x 10^23 P2S5 molekülüne ihtiyaç vardır.
S: P2S5’in adı nedir?
C: P2S5’in adı fosfor pentasülfürdür.
S: P2S5 zayıf bir elektrolit midir?
C: Hayır, P2S5 zayıf bir elektrolit değildir; elektrolit olmayan bir maddedir.
S: P2S5 parçacık boyutunun yanlış olup olmadığını nasıl anlarım?
C: P2S5’in hatalı parçacık boyutu, bileşiğin beklenen fiziksel özellikleri ve davranışındaki sapmalar gözlemlenerek belirlenebilir.
S: P2S5 ochem2 nedir?
C: “ochem2”, organik kimya alanında P2S5 için tanınan bir terim veya isim değildir.
S: P2S5 bileşiğine ne denir?
C: P2S5 bileşiğine difosfor pentasülfür adı verilir.
S: Kimyada P2S5 nedir?
C: Kimyada P2S5, çeşitli uygulamalarda ve kimyasal reaksiyonlarda kullanılan bir bileşik olan difosfor pentasülfürün moleküler formülünü temsil eder.
