Etilen olarak da bilinen etilen, tatlı bir kokuya sahip, renksiz, yanıcı bir gazdır. Plastik, solvent ve diğer kimyasalların üretiminde kullanılan kimya endüstrisinin önemli bir parçasıdır.
| IUPAC’ın adı | Eten |
| Moleküler formül | C2H4 |
| CAS numarası | 74-85-1 |
| Eş anlamlı | Etilen, Eten (yanlışlıkla), Yağlayıcı gaz, Elayl, 1,2-Dihidrojen etilen |
| InChI | InChI=1S/C2H4/c1-2/h1-2H2 |
Etilen formülü
Etenin kimyasal formülü C2H4’tür. Bir eten molekülünde bulunan atomların sayısını ve türünü temsil eder. Formül, bir reaksiyonun stokiyometrisinin veya belirli bir endüstriyel işlem için gereken etilen miktarının belirlenmesi gibi etilen içeren kimyasal reaksiyonlarda ve hesaplamalarda kullanılır.
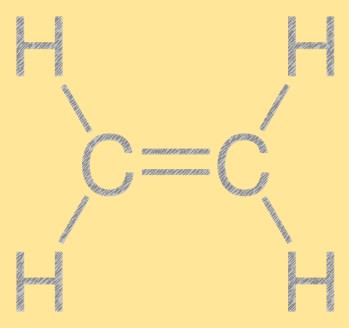
Etilen yapısı
Etilen, çift bağla bağlanan iki karbon atomu ve her karbon atomuna dört hidrojen atomu bağlı olan basit bir doğrusal yapıya sahiptir. Karbon-karbon çift bağı, etilenin reaktivitesinden sorumludur ve bu da onu kimya endüstrisinde faydalı bir yapı taşı haline getirir. Molekül, tüm atomların aynı düzlemde yer aldığı düzlemsel bir yapıya sahiptir.
Eten Molar Kütlesi
Etilen olarak da adlandırılan etenin molar kütlesi 28,05 g/mol’dür. C2H4 kimyasal formülü ile temsil edilen, iki karbon atomu ve dört hidrojen atomundan oluşan basit bir organik moleküldür. Molar kütle, moleküldeki tek tek atomların atomik kütlelerinin eklenmesiyle hesaplanır.
Molar kütle, kimyasal reaksiyonlarda ve etilen içeren hesaplamalarda önemli bir parametredir. Bir reaksiyonda ihtiyaç duyulan etilen miktarının yanı sıra üretilebilecek ürün miktarını belirlemek için kullanılır.
Etilen kaynama noktası
Etenin kaynama noktası -103,7°C’dir (-154,7°F). Etilen oda sıcaklığında ve basıncında bir gazdır ve kaynama noktası suyunkinden çok daha düşüktür, bu da endüstriyel işlemlerde diğer maddelerden ayrılmasını kolaylaştırır.
Etenin kaynama noktası numunenin basıncına ve saflığına bağlıdır. Daha yüksek basınçlarda etenin kaynama noktası artar. Benzer şekilde numunede bulunan yabancı maddeler kaynama noktasının beklenen değerden farklı olmasına neden olabilir.
Eten Erime Noktası
Etilenin erime noktası -169,2°C’dir (-272,6°F). Etilen, doğrusal şekle sahip, polar olmayan bir moleküldür, bu da onu diğer birçok organik bileşiğe kıyasla nispeten basit bir molekül haline getirir. Bu, düşük erime noktasına da yansır.
Kaynama noktası gibi etilenin erime noktası da numunenin saflığına bağlı olarak değişebilir. Safsızlıklar erime noktasını düşürebilir ve deneysel amaçlarla saf bir numune elde edilmesini zorlaştırabilir.
Etilen yoğunluğu g/ml
Etilen yoğunluğu, 0°C (32°F) ve 1 atm basınç olarak tanımlanan standart sıcaklık ve basınç (STP) koşulları altında 0,958 g/mL’dir. Etilen havadan daha az yoğundur, bu da atmosferde yükselip dağılabileceği anlamına gelir.
Yoğunluk etilenin önemli bir fiziksel özelliğidir çünkü endüstriyel işlemlerde belirli bir alan hacmi için gereken etilen miktarını belirlemek için kullanılır. Aynı zamanda bir numunedeki etilenin kütlesini hesaplamak için de kullanılır.
Etilen moleküler ağırlığı
Etilenin moleküler ağırlığı 28,05 g/mol’dür. Molekülünü oluşturan atomların atom ağırlıklarının toplamıdır. Molekül ağırlığı, birçok kimyasal hesaplamada, özellikle bir reaksiyonun stokiyometrisinin ve gerekli veya üretilen reaktanların ve ürünlerin miktarının belirlenmesinde önemli bir parametredir.
| Dış görünüş | Renksiz gaz |
| Spesifik yoğunluk | 20°C’de (68°F) 0,968 g/mL |
| Renk | Renksiz |
| Koku | Tatlı, baharatlı |
| Molar kütle | 28,05 gr/mol |
| Yoğunluk | 0°C ve 1 atm’de 0,958 g/mL |
| Füzyon noktası | -169,2°C (-272,6°F) |
| Kaynama noktası | 1 atm basınçta -103,7°C (-154,7°F) |
| Flaş noktası | -136°C (-213°F) |
| sudaki çözünürlük | 25°C’de (77°F) 3,5 g/L |
| çözünürlük | Suda çözünmez, organik çözücülerde çözünür |
| Buhar basıncı | 20°C’de (68°F) 114,6 kPa |
| Buhar yoğunluğu | 0,97 (hava = 1) |
| pKa | 44 |
| pH | Etilen sulu bir çözelti olmadığından uygulanamaz |
Etilen Güvenliği ve Tehlikeleri
Etilen, havayla patlayıcı karışımlar oluşturabilen oldukça yanıcı bir gazdır. Konsantrasyon yeterince yüksekse havada kendiliğinden tutuşabilir. Etilen aynı zamanda boğucu bir maddedir ve kapalı alanlarda oksijenin yerini alarak şok edici bir tehlike oluşturabilir.
Sıvı etilen ile temas veya yüksek konsantrasyonda gaza maruz kalma, donma veya yanıklara neden olabilir. Etilen toksik değildir ancak karbon monoksit ve karbon dioksit dahil olmak üzere yanma ürünleri insan sağlığına zararlı olabilir.
Etilenle çalışmak, yeterli havalandırma, kişisel koruyucu ekipman ve yangın güvenliği önlemleri dahil uygun güvenlik önlemlerini gerektirir. Etilen iyi havalandırılan alanlarda, tutuşma kaynaklarından uzakta saklanmalı ve taşınmalıdır.
| Tehlike sembolleri | Yanıcı gaz (GHS02), basit boğucu (GHS09) |
| Güvenlik Açıklaması | Tutuşturucu kaynaklardan uzak tutun – Sigara içmeyin. Yalnızca kıvılcım çıkarmayan aletler kullanın. Gaz solumayın. Yalnızca açık havada veya iyi havalandırılmış bir alanda kullanın. Koruyucu eldiven/koruyucu kıyafet/göz koruyucu/yüz koruyucu kullanın. |
| BM kimlik numaraları | UN 1962 (sıkıştırılmış gaz) |
| HS kodu | 2901.21.00 |
| Tehlike sınıfı | 2.1 (yanıcı gaz) |
| Paketleme grubu | Yok |
| Toksisite | Toksik olmayan |
Etilen sentez yöntemleri
Etileni sentezlemek için hidrokarbonların termal parçalanması ve alkollerin dehidrasyonu dahil olmak üzere çeşitli yöntemler kullanılabilir.
Termal parçalamada süreç, uzun zincirli molekülleri daha küçük moleküllere parçalamak ve böylece etilen üretmek için metan, propan ve nafta gibi hidrokarbonların bir katalizör varlığında yüksek sıcaklıklarda (500 ila 900 °C) ısıtılmasını içerir. ürünler.
Diğer bir yaygın yöntem, etanolü veya diğer alkolleri dehidre etmek ve etilen ve su oluşturmak için yüksek sıcaklıklarda (250-350°C) alümina veya silika gibi bir katalizörün kullanılmasını içeren alkol dehidrasyonudur.
Buharla parçalama, etilen ve diğer ürünlerden oluşan bir karışım oluşturmak için hidrokarbonlara yüksek sıcaklıklarda (700-900°C) buharın eklendiği, etilen üretmek için kullanılan başka bir işlemdir.
Ahşap, kağıt ve plastik gibi organik malzemelerin termal ayrışması da etilen üretebilir.
Etileni sentezlemenin diğer yöntemleri arasında etanın oksidatif dehidrojenasyonu ve metanolün olefinlere dönüştürülmesi işlemi yer alır.
Etilen kullanımları
Etilen, geniş bir kullanım alanına sahip önemli bir endüstriyel kimyasaldır.
- Etilen, dünyada en yaygın kullanılan plastiklerden biri olan polietilenin üretiminde önemli bir rol oynamaktadır. İnsanlar polietileni ambalaj, boru ve inşaat malzemeleri gibi çeşitli uygulamalarda kullanırlar.
- Üreticiler, polivinil klorür (PVC) gibi diğer polimerlerin üretiminde etileni ana bileşen olarak kullanıyor. PVC yapı malzemeleri, tıbbi cihazlar ve elektrik kablolarında faydalıdır.
- Etilen ayrıca deterjan, solvent ve plastik üretiminde önemli bir hammadde olan etilen oksit üretiminde de çok önemlidir.
- Üreticiler, motorlar için bir soğutucu ve antifriz olan etilen glikol üretmek için etilen kullanıyor. Aynı zamanda polyester elyaf, film ve reçine üretiminde de hammaddedir.
- Etilen, metallerin kaynaklanması ve kesilmesi için yakıt olarak kullanılır. Aynı zamanda meyve ve sebzelerde olgunlaştırıcı madde olarak da görev yapar.
- Etilen, etanol ve asetaldehit dahil olmak üzere çeşitli organik bileşiklerin sentezinde faydalıdır.
Genel olarak, etilenin çok yönlülüğü, onu çok çeşitli endüstriyel proseslerde önemli bir bileşen haline getirerek modern yaşamın birçok yönüne katkıda bulunur.
Sorular:
Diels-Alder reaksiyonunda hangi dienler etilen ile reaksiyona girer?
İki konjuge çift bağ içeren herhangi bir dien, eten ile Diels-Alder reaksiyonuna girebilir. Bu tür dienlerin örnekleri arasında 1,3-butadien ve izopren yer alır.
Etende hidrojen atomları nasıl düzenlenmiştir?
Etende iki karbon atomu birbirine çift bağla bağlıdır. Her karbon atomu aynı zamanda iki hidrojen atomuna da bağlıdır; geri kalan değerlikler, her karbon atomundaki iki paylaşılmamış elektron çifti tarafından işgal edilir. Her karbonun etrafındaki atomların düzeni trigonaldir.
Eten C2H4’te sp2 hibridizasyonu meydana geldiğinde kaç pi bağı oluşur?
Etende sp2 hibridizasyonu meydana geldiğinde, iki karbon atomu arasında bir pi bağı oluşur. Sp2 hibrit yörüngeleri, karbon atomları ve hidrojen atomları arasında sigma bağlarının oluşumuna katılırken, her karbon atomunun p yörüngeleri pi bağını oluşturmak için üst üste gelir. Etilen doymamış bir hidrokarbon olarak sınıflandırılır çünkü iki karbon atomu arasında çift bağ vardır. Bu çift bağ, bir sigma bağı ve bir pi bağından oluşur; bu, etenin, aynı sayıda karbon atomuna sahip karşılaştırılabilir doymuş hidrokarbondan daha az hidrojen atomuna sahip olduğu anlamına gelir.
