Karbonat iyonu CO32-, bir karbon atomu, üç oksijen atomundan ve -2 genel yükten oluşan negatif yüklü bir iyondur. Yaygın olarak kalsit ve dolomit gibi minerallerin yanı sıra bikarbonat gibi sulu çözeltilerde de bulunur. Okyanuslarda ve diğer su kütlelerinde pH seviyelerinin kontrolünde çok önemli bir rol oynar.
| IUPAC Adı | Karbonat İyonu |
| Moleküler formül | CO32- |
| CAS numarası | 497-19-8 |
| Eş anlamlı | Karbonik asit, Karbon trioksit |
| InChI | InChI=1S/CH2O3.2K/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Karbonat iyonlarının özellikleri
Karbonat Formülü
Karbonat iyonunun formülü CO3^2- ile temsil edilir; burada C karbonu, O oksijeni ve 2- sembolü iyonun negatif yükünü temsil eder. Bu formül, karbonat iyonunda üç oksijen atomu ve bir karbon atomu bulunduğunu gösterir ve ona karakteristik moleküler yapısını verir.
CO3 Karbonat Yükü
Karbonat iyonu CO3^2-, kimyasal formülünde üç oksijen atomu ve bir karbon atomu bulunması nedeniyle negatif yüke 2 sahiptir. Negatif yük, karbonat iyonundaki ekstra elektronların varlığından kaynaklanır ve bu da onu negatif yüklü bir iyon yapar.
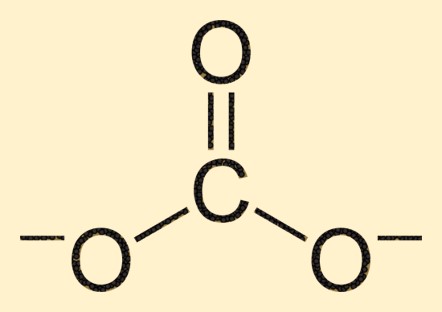
Karbonat yapısı
Karbonat iyonu, merkezinde üçgen düzlemsel bir düzenlemede üç oksijen atomu ile çevrelenmiş bir karbon atomundan oluşur. Karbon atomu bir oksijen atomuyla çift bağ oluştururken diğer iki oksijen atomu karbon atomuna tekli bağlarla bağlanır. Bu yapı CO3 2- iyonuna karakteristik şeklini ve özelliklerini verir.
Karbonat İyonu Molekül Ağırlığı
Karbonat iyonunun moleküler ağırlığı, onu oluşturan elementlerin (karbon, oksijen) atom ağırlıkları temel alınarak hesaplanan yaklaşık 60,01 g/mol’dür. Karbonik asidin moleküler ağırlığı, bir numunedeki karbonik asit miktarının belirlenmesinin yanı sıra fiziksel ve kimyasal özelliklerinin belirlenmesinde de önemlidir.
| Dış görünüş | Katı beyaz toz |
| Spesifik yer çekimi | 2.5 |
| Renk | Beyaz |
| Koku | Hiçbiri |
| Molar kütle | 100,09 gr/mol |
| Yoğunluk | 2,83 gr/cm3 |
| Füzyon noktası | 825°C |
| Kaynama noktası | 1484°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Suda çözünebilir |
| çözünürlük | Asitlerde çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| PKa | 10:33. |
| PH | 8.6 |
Karbonat iyonlarının güvenliği ve tehlikeleri
Karbonat iyonu CO32- çeşitli endüstrilerde yaygın olarak kullanılmaktadır ancak dikkatli kullanılmalıdır. Yüksek düzeyde karbonat tozunun solunması solunum sorunlarına neden olabilirken, büyük miktarlarda yutulması sindirim sorunlarına neden olabilir. Cilt ile teması tahrişe ve cilt lezyonlarına neden olabilir. Ayrıca yanıcıdır ve diğer kimyasallarla reaksiyona girerek tehlikeli gazlar üretebilir. Kaza riskini en aza indirmek için kişisel koruyucu ekipman giymek ve karbonat iyonlarını uygun kaplarda saklamak gibi güvenlik önlemlerine uymak önemlidir.
| Tehlike sembolü | Hiçbiri |
| Güvenlik Açıklaması | Tehlikeli olarak kabul edilmez ve herhangi bir özel tehlike sembolüyle ilişkilendirilmez. |
| BİR KİMLİK | Yok |
| HS kodu | Yok |
| Tehlike sınıfı | Yok |
| Paketleme grubu | Yok |
| Toksisite | Toksik olmayan |
Karbonat iyonu sentez yöntemleri
Karbonat iyonları (CO3 2- ), çeşitli farklı yöntemlerle sentezlenebilir. CO3 2- iyonlarını üretmenin en yaygın yöntemi karbondioksit ve suyun reaksiyona sokulmasıdır. Bu reaksiyon, daha sonra karbonik asit üretmek üzere sodyum hidroksit gibi bir alkali ile nötrleştirilebilen bir karbonik asit çözeltisi üretir. Karbonik asit, katotta karbonat iyonlarının oluştuğu bir tuz çözeltisinin elektrolizi yoluyla da üretilebilir. Bu iyonlar laboratuvarda asit ve karbonat tuzu arasındaki kimyasal reaksiyonla da üretilebilir.
Karbonat İyonlarının Kullanım Alanları
Endüstriler karbonik asidi çeşitli amaçlar için yaygın olarak kullanır. Kabartma tozu üreticileri, antiasit üreticileri ve içecek şirketleri genellikle ürünlerine karbonik asit katar. Su arıtma endüstrisi, karbonat iyonlarını kullanarak içme suyundaki ve yüzme havuzlarındaki pH seviyelerini kontrol eder. İnşaat sektörü, beton yapımında çimentonun ana bileşeni olarak CO3 2- iyonlarını kullanır. Çiftçiler toprağın alkaliliğini artırmak ve mahsul büyümesini teşvik etmek için toprağa karbonat iyonları ekler. Kimya endüstrisi, çeşitli kimyasal reaksiyonlarda katalizör ve reaktif olarak karbonat iyonlarını kullanır. Gıda endüstrisi, karbonat iyonlarını bünyesine katarak gıdaları korur. Çok yönlülükleri nedeniyle karbonat iyonları birçok günlük üründe ve endüstriyel süreçte önemli bir rol oynar.
