Cıva klorür HgCl2 formülüne sahip toksik bir bileşiktir. Laboratuvarlarda reaktif ve dezenfektan olarak kullanılan beyaz kristalli bir katıdır ancak uygun şekilde kullanılması önemlidir.
| IUPAC Adı | Cıva(II) klorür |
| Moleküler formül | HgCl2 |
| CAS numarası | 7487-94-7 |
| Eş anlamlı | Cıva diklorür, cıva diklorür, cıva biklorür, cıva (II) diklorür |
| InChI | InChI=1S/2ClH.Hg/h2*1H;/q;;+2/p-2 |
Cıva klorürün özellikleri
Cıva Klorür Formülü
Cıva diklorürün formülü HgCl2’dir. Bir cıva (Hg) atomu ve iki klor (Cl) atomundan oluşur. Bu bileşik aynı zamanda cıvanın +2 oksidasyon durumunu simgeleyen cıva(II) klorür olarak da bilinir.
Cıva Klorür Molar Kütlesi
Cıva diklorürün molar kütlesi yaklaşık 271,52 g/mol’dür. Bir cıva atomunun (200,59 g/mol) ve iki klor atomunun (her biri 35,45 g/mol) atomik kütlelerinin eklenmesiyle hesaplanır.
Cıva klorürün kaynama noktası
Cıva diklorürün kaynama noktası yaklaşık 302°C’dir (575,6°F). Bu sıcaklıkta katı cıva diklorür buhara dönüşür.
Cıva klorürün erime noktası
Cıva diklorürün erime noktası yaklaşık -71°C’dir (-95,8°F). Bu sıcaklıkta katı cıva diklorür sıvıya dönüşür.
Cıva klorürün yoğunluğu g/mL
Cıva diklorürün yoğunluğu yaklaşık 5,4 g/mL’dir. Bu yüksek yoğunluk onu nispeten ağır bir madde yapar.
Cıva Klorür Molekül Ağırlığı
Cıva diklorürün moleküler ağırlığı yaklaşık 271,52 g/mol’dür. Bileşiğin bir molünün kütlesini gösterir ve atom ağırlıklarının toplamına karşılık gelir.
Cıva klorürün yapısı
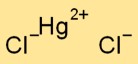
Cıva diklorür kristal bir yapıya sahiptir. İyonik bağlarla bir arada tutulan pozitif yüklü cıva iyonlarından (Hg2+) ve negatif yüklü klorür iyonlarından (Cl-) oluşur. Düzenleme kafes benzeri bir desen oluşturur.
Cıva klorürün çözünürlüğü
Cıva diklorürün suda çözünürlüğü sınırlıdır. Yaklaşık 7,7 gram cıva diklorür, oda sıcaklığında (20°C) 100 ml suda çözülebilir. Çözünürlüğü yüksek sıcaklıklarla artar.
Cıva diklorür oldukça zehirli bir maddedir ve çok dikkatli kullanılmalıdır. Kimyasal laboratuvarlarda reaktif olarak, dezenfektan olarak ve elektrokaplama işlemleri dahil olmak üzere çeşitli uygulamalarda yaygın olarak kullanılmaktadır. Toksisitesi nedeniyle bu bileşikle çalışırken uygun güvenlik protokollerinin takip edilmesi önemlidir.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 5.4g/ml |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 271,52 gr/mol |
| Yoğunluk | 5.4g/ml |
| Füzyon noktası | -71°C (-95,8°F) |
| Kaynama noktası | 302°C (575,6°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Sınır |
| çözünürlük | Alkol, eter gibi organik çözücülerde çözünür |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | 8.23 (hava = 1) |
| pKa | Uygulanamaz |
| pH | Asit (suda) |
Cıva klorürün güvenliği ve tehlikeleri
Cıva diklorür aşırı toksisitesi nedeniyle önemli güvenlik riskleri oluşturur. Cilde doğrudan temas etmesi veya buharlarının solunması ciddi sağlık sorunlarına neden olabilir. Eldiven ve solunum cihazı gibi uygun koruyucu ekipmanlar kullanılarak, büyük bir dikkatle kullanılması önemlidir. Maruziyeti en aza indirmek için daima iyi havalandırılmış bir alanda çalışın. Uyumsuz maddelerden uzakta, sıkıca kapalı kaplarda saklayın. Yutulması veya kazara maruz kalması durumunda derhal tıbbi yardıma başvurun. Çevrenin kirlenmesini önlemek için uygun imha yöntemleri takip edilmelidir. Genel olarak, cıva diklorürle uğraşırken güvenlik protokollerine sıkı sıkıya bağlı kalmak çok önemlidir.
| Tehlike sembolleri | Kafatası ve çapraz kemikler, aşındırıcı |
| Güvenlik Açıklaması | Çok zehirli ve aşındırıcı. Son derece dikkatli kullanın. Doğrudan temastan ve dumanları solumaktan kaçının. |
| BM kimlik numaraları | UN1624 (Cıva bileşikleri, no.) |
| HS kodu | 2852.10.10 |
| Tehlike sınıfı | 6.1 (Zehirli maddeler) |
| Paketleme grubu | II (Orta Seviye) |
| Toksisite | İnsanlar ve hayvanlar için son derece zehirlidir. Dikkatli kullanın ve sıkı güvenlik protokollerini izleyin. |
Cıva klorür sentezi için yöntemler
Cıva diklorürü sentezlemek için farklı yöntemler vardır.
Yaygın bir yaklaşım metalik cıvanın hidroklorik asitle reaksiyonunu içerir. Kontrollü bir ortamda, cıva diklorür üretmek ve hidrojen gazı açığa çıkarmak için aside cıva ekleyin. Bu reaksiyonun kimyasal denklemi şöyledir:
Hg + 2HCl -> HgCl2 + H2
Başka bir yöntem, cıva oksit (HgO) ile hidroklorik asit arasındaki reaksiyonu kullanır. Cıva diklorür ve su oluşturmak için cıva oksidi asitle birleştirin:
HgO + 2HCl -> HgCl2 + H2O
Ek olarak cıva diklorür, cıvanın klor gazı ile reaksiyona sokulmasıyla üretilebilir:
Hg + Cl2 -> HgCl2
Toksik ve aşındırıcı yapısı nedeniyle cıva diklorür sentezini yalnızca iyi havalandırılmış bir başlık altında veya kontrollü koşullar altında gerçekleştirmeyi unutmayın. Sentez işlemi sırasında zararlı maruziyetten kaçınmak için dikkatli kullanım ve güvenlik önlemlerinin alınması önemlidir.
Cıva klorürün kullanım alanları
Cıva(II) klorür olarak da bilinen cıva diklorür, benzersiz özellikleri nedeniyle farklı alanlarda çeşitli uygulamalar bulmuştur. İşte ana kullanımlarından bazıları:
Laboratuvar Reaktifi: Cıva diklorür, kimya laboratuvarlarında çeşitli analitik ve sentetik prosedürler için önemli bir reaktif olarak hizmet eder.
Dezenfektan: Güçlü antimikrobiyal özellikleri, onu özellikle ekipman ve yüzeylerin sterilizasyonunda bir dezenfektan olarak değerli kılar.
Tıp: Toksisitesi nedeniyle sınırlı olmasına rağmen geleneksel tıpta belirli durumlar için kullanılmıştır.
Fotoğrafçılık: Geçmişte, cıva klorür erken fotoğrafçılıkta, fotoğraf geliştirmede sabitleme maddesi olarak rol oynamıştı.
Elektrokaplama: Elektrokaplama işlemlerinde bireyler, çeşitli nesneler üzerinde metalik kaplamalar biriktirmek için elektrolit olarak cıva diklorürü kullanırlar.
Ahşabın Korunması: Tarih boyunca insanlar ahşabı işlemek, çürümeye ve zararlılara karşı korumak için kullanmışlardır.
Tekstil endüstrisi: Üreticiler, boyama işlemleri sırasında tekstillerden rengi çıkarmak için cıva klorür kullandılar.
Analitik Kimya: Kimyacılar bunu kimyasal analizde belirli testler ve reaksiyonlar için kullanırlar.
Niş organik sentez: belirli organik sentez reaksiyonlarında uygulama bulur.
Mantar ilacı ve yosun ilacı: Çiftçiler bunu tarımda mantar ve alglerin büyümesini kontrol etmek için aktif olarak mantar ilacı ve yosun ilacı olarak kullanıyor.
Sorular:
S: HgCl2 suda çözünür mü yoksa çözünmez mi?
C: HgCl2 suda az çözünür.
S: HgCl2 bileşiğinin katyonu ve anyonu nedir?
A: Katyon Hg2+ (cıva) ve anyon Cl-‘dir (klorür).
S: HgCl2 iyonik mi yoksa kovalent mi?
C: HgCl2 iyonik bir bileşiktir.
S: Minecraft’ta Cıva Klorür nasıl yapılır?
C: Minecraft’ta Cıva Diklorür, Cıva ve Klor’un bir üretim masasında birleştirilmesiyle sentezlenebilir.
S: Cıva klorür ne için kullanılır?
C: Cıva diklorür laboratuvarlarda reaktif ve dezenfektan olarak kullanılır.
Soru: Cıva klorürü kim icat etti?
C: Cıva diklorürün keşfi ve ilk kullanımları çok eskilere dayandığından belirli bir envanteri yoktur.
S: Minecraft Education Edition’da Cıva Klorür nasıl yapılır?
C: Minecraft Education Edition’da, tıpkı standart Minecraft versiyonunda olduğu gibi, Merkürik Diklorür, cıva ve klorun bir üretim masasında birleştirilmesiyle oluşturulabilir.
S: Cıva klorür nedir?
C: Cıva diklorür, HgCl2 kimyasal formülüne sahip toksik bir bileşiktir.
S: HgCl2 katı mıdır?
C: Evet, HgCl2 oda sıcaklığında katıdır.
S: İyonik adlandırmada HgCl2’nin doğru adı nedir?
C: İyonik adlandırmada HgCl2’nin doğru adı cıva(II) diklorürdür.
S: HgCl2’nin adı nedir?
C: HgCl2’nin adı cıva diklorürdür.
Soru: 2 HgCl2(aq) + C2O4^(2-)(aq) → 2 Cl^-(aq) + 2 CO2(g) + Hg2Cl2(s), reaksiyonun hız kanunu nedir?
A: Hız kanunu: Hız = k[HgCl2]^2[C2O4^2-] (HgCl2’ye göre ikinci dereceden ve C2O4^2-‘ye göre birinci dereceden).
