Çinko sülfür (ZnS), çinko ve kükürtten oluşan bir bileşiktir. LED ekranlar için ışıldayan malzemeler, optoelektronik ve fosforlar dahil olmak üzere çeşitli uygulamalarda kullanılır.
| IUPAC Adı | Çinko sülfür |
| Moleküler formül | ZnS |
| CAS numarası | 1314-98-3 |
| Eş anlamlı | Sfalerit, Blende, Çinko Blende, Wurtzite |
| InChI | InChI=1S/S.Zn |
Çinko sülfürün özellikleri
Çinko Sülfür Formülü
Çinko sülfürün kimyasal formülü, çinko (Zn) ve kükürt (S) atomlarından oluşan bileşimini gösteren ZnS’dir. Bu bileşik, benzersiz özellikleri nedeniyle çeşitli endüstriyel ve bilimsel uygulamaların önemli bir parçasını oluşturur.
Çinko Sülfür Molar Kütlesi
Çinko sülfürün molar kütlesi mol başına yaklaşık 97,45 gramdır. Bu değer, tek bir ZnS molekülündeki çinko ve kükürt atomlarının birleşik atomik kütlelerini temsil eder.
Çinko sülfürün kaynama noktası
Çinko sülfürün belirgin bir kaynama noktası yoktur çünkü ısıtıldığında gerçek bir kaynama sürecine girmek yerine ayrışma eğilimindedir. Bu özellik kimyasal özelliklerinden kaynaklanmaktadır.
Çinko Sülfürün Erime Noktası
Çinko sülfürün erime noktası yaklaşık 1.850 santigrat derecedir (3.362 derece Fahrenheit). Bu yüksek erime noktası onu çeşitli yüksek sıcaklık uygulamaları için uygun kılar.
Çinko sülfürün yoğunluğu g/mL
Çinko sülfürün yoğunluğu kristal formuna bağlı olarak değişir. Genellikle yoğunluğu santimetre küp başına 3,98 ila 4,09 gram (g/cm³) arasındadır. Bu yoğunluk aralığı optik malzemelerde kullanımına katkıda bulunur.
Çinko Sülfür Molekül Ağırlığı
Bileşenlerinin atomik kütlelerinin eklenmesiyle hesaplanan çinko sülfürün moleküler ağırlığı, mol başına yaklaşık 97,45 gramdır. Bu değer belirli bir numunedeki ZnS miktarının belirlenmesi için çok önemlidir.
Çinko sülfürün yapısı
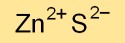
Çinko sülfür, öncelikle kübik çinko blende (sfalerit olarak da bilinir) ve altıgen wurtzit olmak üzere farklı kristal yapılarda bulunur. Atomların bu düzenlemeleri onun fiziksel ve optik özelliklerini belirler.
Çinko sülfürün çözünürlüğü
Çinko sülfür suda çok az çözünür, bu da onu neredeyse çözünmez hale getirir. Bu özellik, çinko ve kükürt atomları arasındaki güçlü bağlardan kaynaklanmaktadır ve bu da sulu çözeltilerde sınırlı çözünmeye neden olmaktadır. Ancak belirli koşullar altında belirli asit veya alkalilerde çözülebilir.
| Dış görünüş | Sağlam |
| Spesifik yer çekimi | 3,98 – 4,09 gr/cm³ |
| Renk | Beyaz, sarı, kahverengi, siyah |
| Koku | Kokusuz |
| Molar kütle | ~97,45 gr/mol |
| Yoğunluk | 3,98 – 4,09 gr/cm³ |
| Füzyon noktası | ~1850°C (~3362°F) |
| Kaynama noktası | ayrıştırılmış |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Neredeyse çözünmez |
| çözünürlük | Belirli koşullar altında asitlerde ve alkalilerde çözünür |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | ~4.7 |
| pH | ~7 (nötr) |
Çinko Sülfürün Güvenliği ve Tehlikeleri
Çinko sülfürün akut toksisitesi düşüktür ancak ısıtıldığında toksik kükürt dioksit açığa çıkarabilir. Normal kullanım koşulları altında genellikle güvenli kabul edilir. Ancak tozunun veya buharının solunması solunum yolu tahrişine neden olabilir. Cilt ve gözlerle temasından kaçının. Maruz kalma durumunda iyice durulayın ve tahriş devam ederse doktora başvurun. Ateş veya aşırı ısı, ayrışmaya neden olabilir ve tehlikeli gazların açığa çıkmasına neden olabilir. Uyumsuz malzemelerden uzakta saklayın. Güvenliği sağlamak ve çinko sülfürle ilişkili olası tehlikeleri önlemek için dikkatli kullanın, uygun koruyucu ekipman giyin ve iyi havalandırılan alanlarda çalışın.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Düşük akut toksisite; ısıtıldığında zehirli kükürt dioksit gazı açığa çıkarır; dikkatli tutun |
| BM kimlik numaraları | Uygulanamaz |
| HS kodu | 2830.90.10 |
| Tehlike sınıfı | Tehlikeli olarak sınıflandırılmadı |
| Paketleme grubu | Uygulanamaz |
| Toksisite | Düşük toksisite; toz veya dumandan kaynaklanan solunum tahrişi; dikkatli tutun |
Çinko sülfit sentez yöntemleri
Çinko sülfür çeşitli yöntemlerle sentezlenebilir. Yaygın bir yaklaşım , çinko oksit (ZnO) ve hidrojen sülfit (H2S) gazlarının yüksek sıcaklıklarda reaksiyona sokulmasıdır. Reaksiyon şu şekilde ilerler:
ZnO (k) + H2S (g) → ZnS (k) + H2O (g)
Başka bir yöntem çinko klorür (ZnCl2) ile hidrojen sülfür gazı arasındaki reaksiyonu içerir:
ZnCl2 (sulu) + H2S (g) → ZnS (k) + 2 HCl (g)
Alternatif olarak çinko sülfür nanopartikülleri çökeltme yöntemleri kullanılarak sentezlenebilir. Bu, çözünür çinko tuzlarının kontrollü koşullar altında çözünür sülfit tuzları ile karıştırılmasını içerir ve bu da çinko sülfit nanopartiküllerinin oluşumuna yol açar. Bazı durumlarda organik bileşikler, parçacık boyutunu ve stabilitesini kontrol etmek için kapatma maddeleri olarak kullanılır.
Çinko sülfür ayrıca metalik çinkonun elementel kükürt ile reaksiyona sokulmasıyla da hazırlanabilir. Reaksiyonu başlatmak için iki madde birlikte ısıtılır:
Zn(ler) + S(ler) → ZnS(ler)
Bu yöntemler, optoelektronik, ışıldayan malzemeler vb. gibi farklı uygulamalar için değişen özelliklere sahip çinko sülfit üretiminde çok yönlülük sağlar.
Çinko Sülfürün Kullanım Alanları
Çinko sülfür, benzersiz özelliklerinden dolayı çeşitli endüstrilerde çeşitli uygulamalar bulur. İşte dikkate değer kullanımları:
- Optik Kaplamalar: Kızılötesi bölgedeki çinko sülfürün şeffaflığı, onu termal görüntüleme sistemleri ve sensörlerdeki optik kaplamalar, lensler ve pencereler için değerli bir malzeme haline getirir.
- Işıldayan malzemeler: Karanlıkta parlayan uygulamalar için bakır katkılı çinko sülfür gibi ışıldayan bileşikler oluşturmak için bir ana malzeme görevi görür.
- Yarı İletken Uygulamaları: İnce film transistörlerinde ve diğer yarı iletken cihazlarda çinko sülfür filmleri elektronik bileşenlerde rol oynar.
- LED ekran fosforları: LED ekranlar, rengi ve parlaklığı geliştirmek için çinko sülfür fosforları kullanır.
- X-ışını ve gama ışını tespiti: Sintilasyon dedektörleri, x-ışınlarını ve gama ışınlarını tespit etmek için çinko sülfürün parıldama özelliklerini kullanır.
- Pigmentler ve boyalar: Boyalar, kaplamalar ve baskı mürekkeplerindeki beyaz pigmentler, çinko beyazı veya litopon gibi çinko sülfürün belirli formlarını kullanır.
- Floresan işaretleyiciler: Biyolojik uygulamalarda araştırmacılar, görüntüleme çalışmalarında floresan işaretleyiciler için çinko sülfür nanopartiküllerini işlevselleştirir.
- Güneş pilleri: Bilim adamları, fotovoltaik güneş pillerinde ışık emilimini iyileştirme potansiyellerini belirlemek için çinko sülfit nanopartikülleri üzerinde çalışıyorlar.
- Kataliz: Yarı iletken doğasını keşfeden araştırmacılar, çeşitli kimyasal reaksiyonlarda çinko sülfürün katalitik özelliklerini inceliyorlar.
- Kızılötesi pencereler: Kameralar, teleskoplar ve sensörler gibi optik cihazlar, kızılötesi pencereler için çinko sülfür içerir.
Çinko sülfürün çok yönlülüğü, lüminesans, şeffaflık ve yarı iletken davranış sergileme yeteneğinden kaynaklanmaktadır. Kişiye özel uygulamaları optik, elektronik, enerji ve malzeme bilimi gibi alanlara önemli katkılar sağlıyor.
Sorular:
S: Çinko sülfürün formülü nedir?
C: Çinko sülfürün formülü ZnS’dir.
S: Çinko sülfür çözünür mü?
C: Çinko sülfür genellikle suda çözünmez.
Soru: ZnS suda çözünür mü?
C: Hayır, ZnS suda çözünmez.
S: Çinko sülfür kütlece %67,1 çinko içerir. Çinko sülfürdeki kükürtün kütle oranı nedir?
C: Çinko sülfürdeki kükürtün kütle oranı %32,9’dur.
S: Çinko klorürü çinko sülfürden nasıl ayırabilirsiniz?
C: Çinko klorür ve çinko sülfür, çinko klorürün suda çözülmesi ve çözünmeyen çinko sülfürün geride bırakılmasıyla ayrılabilir.
S: Çinko sülfür iyonik midir?
C: Evet, çinko sülfür öncelikle iyoniktir.
S: ZnS tarafından ne tür stokiyometrik kusur temsil edilir?
C: Çinko sülfür, Frenkel tipi stokiyometrik kusurlar sergileyebilir.
S: ZnS nedir?
C: ZnS, çinko ve kükürt bileşiği olan çinko sülfürün kimyasal formülüdür.
S: ZnS çökelmesini önlemek için gereken minimum pH nedir?
C: ZnS çökelmesini önlemek için gereken minimum pH yaklaşık 4,7’dir.
Soru: Bu görüntü ZnS için kübik birim hücreyi gösteriyor. Bu kübik hücrede kaç tane Zn²⁺ iyonu var?
C: ZnS’nin kübik hücresinde dört Zn²⁺ iyonu vardır.
S: ZnS iyonik mi yoksa kovalent mi?
C: ZnS öncelikle iyonik olarak kabul edilir.
S: Zn + S = ZnS ne tür bir reaksiyondur?
A: Zn + S = ZnS reaksiyonu bir sentez veya kombinasyon reaksiyonudur.
