Florometan (CH3F), hafif eterik kokusu olan renksiz bir gazdır. Elektronik, ilaç üretiminde ve soğutucu olarak kullanılır. Çok zehirli değildir ancak güçlü bir sera gazı oluşturur.
| IUPAC Adı | Florometan |
| Moleküler formül | CH3F |
| CAS numarası | 593-53-3 |
| Eş anlamlı | Metil florür, Freon 41, Halokarbon 41, R 41, UN 2452 |
| InChI | InChI=1S/CH3F/c1-2/h1H3 |
Florometanın özellikleri
CH3F Kaynama noktası
CH3F’nin kaynama noktası -78,4°C’dir ve bu nispeten düşüktür. Bu, onu soğutma ve iklimlendirme sistemleri gibi çeşitli uygulamalar için ideal bir soğutucu haline getirir. CH3F, düşük kaynama noktasından dolayı aerosollerde itici gaz olarak da kullanılır.
CH3F Molar Kütle
CH3F, CH3F moleküler formülüne sahip kimyasal bir bileşiktir. Metil florür olarak da bilinir ve molar kütlesi 34,03 g/mol’dür. CH3F, hafif eterik kokusu olan renksiz bir gazdır ve benzersiz özelliklerinden dolayı çeşitli uygulamalarda yaygın olarak kullanılmaktadır.
CH3F Erime noktası
CH3F’nin erime noktası -141°C’dir ve bu da nispeten düşüktür. Düşük erime noktası, işlenmesini ve nakledilmesini kolaylaştırır, bu da onu çeşitli endüstriyel uygulamalar için popüler bir seçim haline getirir. CH3F’nin düşük erime noktası aynı zamanda onu düşük sıcaklık uygulamalarında soğutucu olarak kullanıma uygun hale getirir.
Yoğunluk CH3F
CH3F’nin yoğunluğu 0,89 g/ml’dir ve bu nispeten düşüktür. Bu, onu 1,29 g/ml yoğunluğa sahip havadan daha az yoğun hale getirir. Sonuç olarak CH3F, sızıntı tespiti, gaz kromatografisi ve balonlar ve hava gemileri için kaldırıcı gaz olarak çeşitli uygulamalarda sıklıkla havadan hafif bir gaz olarak kullanılır.
CH3F Molekül Ağırlığı
CH3F’nin moleküler ağırlığı 34,03 g/mol’dür ve bu nispeten düşüktür. Bu, onu taşıması ve taşıması kolay, hafif bir bileşik haline getirir. CH3F, düşük moleküler ağırlığı ve benzersiz özellikleri nedeniyle elektronik ve ilaç üretiminde sıklıkla kullanılır.
CH3F’nin Yapısı
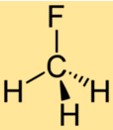
CH3F’nin yapısı, üç hidrojen atomuna ve bir flor atomuna bağlı tek bir karbon atomundan oluşur. Flor atomu, metandaki hidrojen atomlarından birinin yerini alarak karbon atomuna bağlanır. CH3F’nin yapısı onu benzersiz kimyasal özelliklere sahip stabil bir bileşik haline getirir.
Florometan Formülü
Florometan formülü, moleküldeki atomların dizilişini temsil eden CH3F’dir. Formül, florometan’ın bir karbon atomu, üç hidrojen atomu ve bir flor atomundan oluştuğunu gösterir. Formül, florometanın kimyasal bileşimini tanımlamak için kullanılır ve çeşitli uygulamalarda önemlidir.
| Dış görünüş | Renksiz gaz |
| Spesifik yer çekimi | 20°C’de 0,89 (hava = 1) |
| Renk | Renksiz |
| Koku | Hafif eterik koku |
| Molar kütle | 34,03 g/mol |
| Yoğunluk | 0.89g/ml |
| Füzyon noktası | -141°C |
| Kaynama noktası | -78,4°C |
| Flaş noktası | Yanıcı değil |
| sudaki çözünürlük | 20°C’de 0,5 g/L |
| çözünürlük | Organik solventlerle karışabilir |
| Buhar basıncı | 20°C’de 4,4 bar |
| Buhar yoğunluğu | 1,43 (hava = 1) |
| pKa | 50.9 |
| pH | Uygulanamaz |
Florometanın güvenliği ve tehlikeleri
Florometan genellikle işlenmesi ve kullanılması güvenli bir bileşik olarak kabul edilir, toksisitesi düşüktür ve yanıcı değildir. Ancak herhangi bir kimyasal gibi potansiyel tehlikeleri ve güvenlik hususları vardır. Yüksek konsantrasyonlarda florometana maruz kalmak baş dönmesine, baş ağrısına ve mide bulantısına neden olabilir. Aynı zamanda iklim değişikliğine katkıda bulunan güçlü bir sera gazıdır. Florometan iyi havalandırılan bir alanda kullanılmalı ve eldiven ve gözlük gibi koruyucu ekipmanlar kullanılmalıdır. Sızıntıları ve çevreye kazara salınımları önlemek için uygun depolama ve taşıma prosedürlerini takip etmek önemlidir.
| Tehlike sembolleri | F+ |
| Güvenlik Açıklaması | Son derece yanıcı gaz; Solunması halinde toksiktir; Cilt tahrişine neden olur; Ciddi göz tahrişine neden olur; Uyuşukluk veya baş dönmesine neden olabilir; Organ hasarına neden olabilir |
| BİR tanımlayıcılar | UN2452 |
| HS kodu | 2903.49.90 |
| Tehlike sınıfı | 2.1 |
| Paketleme grubu | II |
| Toksisite | Düşük toksisiteye sahiptir ancak yüksek konsantrasyonlarda solunması halinde sağlık açısından olumsuz etkilere neden olabilir. |
Florometan sentez yöntemleri
Doğrudan metanın florlanması ve halojen değişim reaksiyonları dahil olmak üzere çeşitli yöntemler, florometanı sentezleyebilir.
Yaygın bir yöntem, metanolün , alüminyum oksit veya alüminyum florür gibi bir katalizör varlığında hidrojen florür ile reaksiyonudur.
Başka bir yöntem, klorometan veya bromometanın hidrojen florür gazı ile reaksiyonunu içerir. Bu yöntemlerin her ikisi de, daha sonra damıtma veya başka yöntemlerle ayrılabilen ve saflaştırılabilen bir yan ürün olarak florometan üretir.
Florometanı sentezlemenin başka bir yöntemi, floroform ve hidrojen klorürün çinko veya bakır gibi bir katalizör varlığında reaksiyonunu içerir. Bu reaksiyon, damıtma yoluyla ayrılabilen ve saflaştırılabilen bir kloroflorometan ve florometan karışımı üretir.
Florometanın Kullanım Alanları
Florometanın çeşitli endüstrilerde çeşitli kullanımları vardır:
- Soğutma: Kaynama noktasının düşük olması ve alev almaması nedeniyle endüstriyel ve ticari soğutma sistemlerinde soğutucu olarak kullanılır.
- Elektronik: Elektronik bileşenler için temizleme maddesi olarak ve yarı iletken endüstrisinde plazma aşındırma maddesi olarak kullanılır.
- Tıbbi uygulamalar: Düşük toksisitesi ve hızlı etkisi nedeniyle veteriner hekimlikte anestezik olarak kullanılır.
- Pestisit üretimi: Herbisitler ve böcek öldürücüler de dahil olmak üzere bazı pestisitlerin üretiminde öncü olarak kullanılır.
- Polimer üretimi: Poliüretan köpük gibi polimer köpüklerin üretiminde şişirici madde olarak kullanılır.
- Laboratuvar Uygulamaları: Kimyasal sentez ve analiz dahil olmak üzere çeşitli laboratuvar uygulamalarında solvent ve reaktif olarak kullanılır.
- Yangın Söndürme: Ayrıca belirli türdeki yangın söndürücülerde, özellikle bilgisayar ve telekomünikasyon odalarında kullanılanlarda yangın söndürme maddesi olarak kullanılır.
Sorular:
S: CH3F polar mı yoksa polar değil mi?
C: CH3F, florin ve hidrojen atomlarının merkezi karbon atomu etrafında asimetrik düzenlenmesinden dolayı polar bir moleküldür ve net bir dipol momentine neden olur.
S: CH3F’de hidrojen bağı var mı?
C: Florometan, nitrojen, oksijen veya flor gibi yüksek derecede elektronegatif bir elemente bağlı bir hidrojen atomu içermediğinden hidrojen bağına sahip değildir.
S: Moleküller arası kuvvetler en güçlü olan bileşik hangisidir: HF, CH3Cl, CH3F, HCl?
C: HF, diğer bileşiklerin dipol-dipol kuvvetlerinden daha güçlü olan hidrojen bağları oluşturma yeteneğinden dolayı en güçlü moleküller arası kuvvetlere sahiptir.
S: Hangisi en zayıf dipol-dipol kuvvetlerine sahiptir: N2, CO, CH3F, HCl?
C: N2, polar olmayan bir molekül olduğundan ve dolayısıyla net dipol momentine sahip olmadığından en düşük dipol-dipol kuvvetlerine sahiptir. CO, CH3F ve HCl polar moleküllerdir ve dipol-dipol kuvvetlerine sahiptirler ancak moleküllerin artan polaritesinden dolayı bu kuvvetlerin gücü HCl < CH3F < CO sırasına göre artar.
