Tetrabrometan, CBr4 formülüne sahip kimyasal bir bileşiktir. Çözücü ve alev geciktirici olarak kullanılan, tatlı kokulu, renksiz kristal bir katıdır. Zehirlidir ve insanlara ve çevreye zarar verebilir.
| IUPAC Adı | Tetrabrometan |
| Moleküler formül | CBr4 |
| CAS numarası | 558-13-4 |
| Eş anlamlı | Karbon tetrabromür, tetrabromoform, perbromometan, tetra-bromo-metan |
| InChI | InChI=1S/CBr4/c2-1(3,4)5 |
Tetrabrometanın özellikleri
Molar kütle CBr4
Tetrabrometanın molar kütlesi yaklaşık 331,63 g/mol’dür. Diğer organik moleküllerle karşılaştırıldığında nispeten ağır bir bileşiktir. Tetrabromometanın molar kütlesi, moleküldeki tüm atomların atomik kütlelerinin eklenmesiyle belirlenir. Bu durumda bir karbon atomu ve dört brom atomundan oluşur.
CBr4’ün kaynama noktası
Tetrabrometanın kaynama noktası 189°C’dir (372°F). Bu, sıvı tetrabrometanın buhar basıncının atmosfer basıncına eşit olduğu sıcaklıktır. Bu sıcaklıkta sıvı tetrabromometan kaynamaya başlayacak ve buharlaşarak gaz haline gelecektir.
CBr4’ün erime noktası
CBr4’ün erime noktası 90,5 °C’dir (194,9 °F). Bu, katı CBr4’ün sıvı duruma geçtiği sıcaklıktır. CBr4, muhtemelen yüksek molekül ağırlığı ve moleküller arası kuvvetler nedeniyle, organik bir molekül için nispeten yüksek bir erime noktasına sahiptir.
Yoğunluk CBr4 g/ml
Tetrabrometanın yoğunluğu oda sıcaklığında 3,42 g/mL’dir. Bu, belirli bir hacimdeki tetrabrometanın, aynı hacimdeki sudan 3,42 kat daha ağır olduğu anlamına gelir. Tetrabrometanın yüksek yoğunluğu, yüksek molekül ağırlığından ve atomlarının sıkı dizilişinden kaynaklanmaktadır.
Molekül ağırlığı CBr4
Tetrabrometanın moleküler ağırlığı 331,63 g/mol’dür. Moleküldeki tüm atomların toplam ağırlığıdır. Tetrabrometanın moleküler ağırlığı, fiziksel özelliklerinin hesaplanması ve kimyasal reaksiyonlardaki davranışının anlaşılması açısından önemlidir.
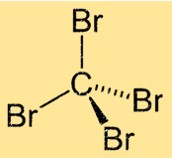
CBr4 yapısı
Tetrabromometan, karbon atomunun merkezde olduğu ve dört bromin atomunun ona bağlı olduğu tetrahedral bir moleküler geometriye sahiptir. Molekül, merkezi karbon atomu etrafında eşit açılarla düzenlenmiş dört özdeş Br-C bağıyla simetrik bir yapıya sahiptir. Bu yapı tetrabrometana eşsiz fiziksel ve kimyasal özelliklerini verir.
Tetrabrometan formülü
Tetrabrometanın formülü CBr4’tür. Bu, bir karbon atomu ve dört brom atomundan oluştuğu anlamına gelir. Tetrabrometanın formülü, kimyasal yapısını anlamak ve diğer moleküllerle reaktivitesini tahmin etmek açısından önemlidir.
| Dış görünüş | Renksiz ila soluk sarı kristal katı |
| Spesifik yer çekimi | 3,42 gr/ml |
| Renk | Renksizden soluk sarıya |
| Koku | Yumuşak |
| Molar kütle | 331,63 gr/mol |
| Yoğunluk | 3,42 gr/ml |
| Füzyon noktası | 90,5°C (194,9°F) |
| Kaynama noktası | 189°C (372°F) |
| Flaş noktası | Yanıcı değil |
| sudaki çözünürlük | 20°C’de 0,0032 g/100 mL |
| çözünürlük | Suda çözünmez, benzen, kloroform ve karbon disülfürde çözünür |
| Buhar basıncı | 25°C’de 0,006 mmHg |
| Buhar yoğunluğu | 14.2 (havaya karşı) |
| pKa | Uygulanamaz |
| pH | Uygulanamaz |
Tetrabrometanın güvenliği ve tehlikeleri
Tetrabrometan, doğru şekilde kullanılmazsa çeşitli tehlikelere neden olabilir. Yutulması, solunması veya cilt ile teması halinde sağlığa zararlıdır. Tetrabrometana maruz kalmak tahrişe, baş ağrısına, baş dönmesine ve mide bulantısına neden olabilir. Uzun süreli maruz kalma karaciğer ve böbrek hasarına neden olabilir. Aynı zamanda potansiyel bir çevresel tehlikedir ve çevreye salınmamalıdır. Tetrabromometanla çalışırken koruyucu kıyafet ve ekipman kullanımı da dahil olmak üzere uygun önlemler alınmalıdır. Kazara maruz kalma durumunda derhal tıbbi yardıma başvurulmalıdır. Tetrabromometan iyi havalandırılan bir alanda ve uygun güvenlik protokollerine uygun olarak saklanmalı ve kullanılmalıdır.
| Tehlike sembolleri | T (toksik) |
| Güvenlik Açıklaması | Yutmayın, solumayın veya ciltle temas ettirmeyin. Koruyucu kıyafet ve ekipman giyin. Kazara maruz kalma durumunda bir doktora danışın. |
| BM kimlik numaraları | BM 2515 |
| HS kodu | 2903.90.9000 |
| Tehlike sınıfı | 6.1 |
| Paketleme grubu | II |
| Toksisite | Yutulması, solunması veya deri yoluyla emilmesi halinde toksiktir. Tahrişe, baş ağrısına, baş dönmesine ve mide bulantısına neden olabilir. Uzun süreli maruz kalma karaciğer ve böbrek hasarına neden olabilir. |
Tetrabromometan sentezi için yöntemler
Tetrabrometan sentezlemek için araştırmacılar metanı bromlayabilir, karbon tetrabromürü hidrojen gazıyla reaksiyona sokabilir veya bromu sodyum formatla reaksiyona sokabilir.
Metan brominasyonu, metanın brom ile demir veya alüminyum bromür gibi bir katalizör varlığında reaksiyonunu içerir. Tetrabromometan elde etme işlemi sonucunda ortaya çıkan bromometan karışımını ayırıp saflaştırabilirsiniz.
Tetrabrometan sentezlemek için karbon tetrabromür, nikel gibi bir katalizör varlığında hidrojen gazı ile reaksiyona sokulabilir. Bu reaksiyon, araştırmacıların tetrabromometan elde etmek için ayırıp saflaştırabileceği bir bromometan karışımı üretir.
Tetrabrometan sentezlemenin başka bir yöntemi, sülfürik asit varlığında bromun sodyum formatla reaksiyonunu içerir. Elde edilen tetrabrometan ve sodyum sülfat ürününün ayrılması ve saflaştırılması tetrabrometan verecektir.
Tetrabrometanın Kullanım Alanları
Tetrabrometan benzersiz özellikleri nedeniyle çeşitli endüstrilerde çeşitli uygulamalara sahiptir. İşte bazı kullanımları:
- Alev Geciktirici: Plastik, tekstil ve diğer malzemelerde alev geciktirici olarak kullanılır. Isıya maruz kaldığında yanma sürecini engelleyen brom açığa çıkararak çalışır.
- Kimyasal Ara Madde: Farmasötikler ve tarım kimyasalları gibi diğer kimyasalların üretiminde kimyasal bir ara madde olarak kullanılır.
- Çözücü: Özellikle pestisit üretiminde çeşitli organik bileşikler için çözücü olarak kullanılır.
- Test maddesi: Diğer kimyasallardaki safsızlıkların tespiti için test maddesi olarak kullanılır.
- Rafinaj maddesi: Alüminyum ve diğer metallerin üretiminde rafinaj maddesi olarak kullanılır.
- Veterinerlik: Veteriner hekimlikte hayvanlardaki paraziter enfeksiyonların tedavisinde antihelmintik veya solucan giderici olarak kullanılır.
Sorular:
S: CBR4 polar mı yoksa polar değil mi?
C: Tetrabromometan (cbr4), simetrik tetrahedral yapısı ve polar bağların olmaması nedeniyle polar olmayan bir moleküldür.
S: Aşağıdaki bileşiklerden hangisi polardır: cbr4, xef2, scl4, brf3, ch3oh?
C: Verilen bileşikler arasında yalnızca CH3OH (metanol) ve BRF3 (brom triflorür), asimetrik moleküler yapıları ve polar bağların varlığı nedeniyle polar moleküllerdir.
S: Cbr4 suda çözünür mü?
C: Tetrabrometan, suyun polar doğasıyla bağdaşmayan, polar olmayan yapısı nedeniyle suda çözünmez.
S: Cbr4 formülüne sahip bileşiğin adı nedir? C: Formül cbr4’e ait bileşiğe tetrabrometan veya karbon tetrabromür denir.
