Kalsiyum sülfat (CaSO4), doğal olarak oluşan veya endüstriyel olarak üretilen beyaz bir tozdur. Bağlayıcı, dolgu ve besleyici özelliğinden dolayı inşaatta, gıdada ve tıpta kullanılır.
| IUPAC Adı | Kalsiyum sülfat |
| Moleküler formül | CaSO4 |
| CAS numarası | 7778-18-9 |
| Eş anlamlı | Alçı, susuz alçı, anhidrit, dihidrat, kalsiyum tuzu, selenit |
| InChI | InChI=1S/Ca.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Kalsiyum sülfatın özellikleri
Kalsiyum sülfat formülü
Kalsiyum sülfatın kimyasal formülü CaSO4’tür. Bu, her kalsiyum sülfat molekülünün bir kalsiyum atomu, bir kükürt atomu ve dört oksijen atomu içerdiği anlamına gelir. Formül, kalsiyum sülfatın bileşimini kimyasal denklemlerde temsil etmek ve kimyasal reaksiyonlarda ihtiyaç duyulan reaktanların miktarını hesaplamak için kullanılır.
Kalsiyum Sülfat Molar Kütlesi
CaSO4’ün molar kütlesi yaklaşık 136,14 g/mol’dür. Bu değer, bileşikteki bir kalsiyum atomu, bir kükürt atomu ve dört oksijen atomunun atomik kütlelerinin eklenmesiyle hesaplanır. Molar kütle, kimyasal reaksiyonlarda ihtiyaç duyulan CaSO4 miktarını belirlemek ve çözeltilerdeki konsantrasyonunu hesaplamak için kullanılır.
Kalsiyum sülfatın kaynama noktası
CaSO4’ün tanımlanmış bir kaynama noktası yoktur çünkü kaynama noktasına ulaşmadan önce termal bozunmaya uğrar. Ancak bozunmaya uğramadan 200°C’nin üzerindeki sıcaklıklara ısıtılabilir. Daha yüksek sıcaklıklarda CaSO4, kalsiyum oksit ve kükürt trioksit oluşturmak üzere endotermik ayrışmaya uğrar.
Kalsiyum Sülfat Erime Noktası
CaSO4’ün erime noktası hidrasyon durumuna bağlıdır. CaSO4’ün susuz formunun erime noktası yaklaşık 1460°C iken dihidrat formunun erime noktası yaklaşık 128°C’dir. Hemihidrat ve trihidrat formları orta düzeyde erime noktalarına sahiptir.
Kalsiyum sülfatın yoğunluğu g/mL
CaSO4’ün yoğunluğu şekline ve hidrasyon durumuna bağlıdır. CaSO4’ün susuz formunun yoğunluğu yaklaşık 2,96 g/mL iken dihidrat formunun yoğunluğu yaklaşık 2,32 g/mL’dir. Hemihidratlı ve trihidratlı formlar orta yoğunluklara sahiptir.
Kalsiyum Sülfat Molekül Ağırlığı
CaSO4’ün moleküler ağırlığı yaklaşık 136,14 g/mol’dür. Bu değer, bileşikteki bir kalsiyum atomu, bir kükürt atomu ve dört oksijen atomunun atomik kütlelerinin eklenmesiyle hesaplanır. Molekül ağırlığı, kimyasal reaksiyonlarda ihtiyaç duyulan CaSO4 miktarını hesaplamak ve çözeltilerdeki konsantrasyonunu belirlemek için kullanılır.
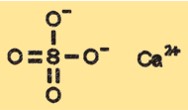
Kalsiyum sülfatın yapısı
CaSO4, hidrasyon durumuna bağlı olarak değişebilen bir kristal yapıya sahiptir. CaSO4’ün susuz formu ortorombik olarak sınıflandırılan bir kristal yapıya sahipken, dihidrat formu monoklinik bir kristal yapıya sahiptir. Hemihidrat ve trihidrat formları, susuz ve dihidrat formları arasında orta düzeyde olan farklı kristal yapılara sahiptir.
| Dış görünüş | Beyaz veya katı toz |
| Spesifik yer çekimi | 2,96 (susuz), 2,32 (dihidrat) |
| Renk | Beyaz veya renksiz |
| Koku | Kokusuz |
| Molar kütle | 136,14 gr/mol |
| Yoğunluk | 2,96 g/cm³ (susuz), 2,32 g/cm³ (dihidrat) |
| Füzyon noktası | 1460°C (susuz), 128°C (dihidrat) |
| Kaynama noktası | Tanımlanmış bir kaynama noktasına sahip değildir |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 0,24g/100ml (20°C) |
| çözünürlük | Suda ve gliserolde çözünür, etanolde çözünmez |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 9,8 (ilk ayrışma), 11,8 (ikinci ayrışma) |
| pH | 7 (nötr) |
Kalsiyum sülfatın güvenliği ve tehlikeleri
CaSO4’ün kullanımı ve işlenmesi genellikle güvenli kabul edilir, ancak uygun şekilde kullanılmazsa bazı sağlık riskleri oluşturabilir. CaSO4 tozunun solunması solunum sisteminde tahrişe neden olabilirken bileşiğin büyük miktarlarda yutulması mide-bağırsak rahatsızlığına neden olabilir. CaSO4’ün göz ve cilt ile teması tahrişe veya kuruluğa neden olabilir. CaSO4 ayrıca bazı kimyasallarla reaksiyona girerek tehlikeli yan ürünler üretebilir. Bu nedenle CaSO4 ile çalışılırken uygun kişisel koruyucu ekipman kullanılmalı ve serin, kuru, iyi havalandırılmış, uyumsuz malzemelerden uzakta bir alanda saklanmalıdır.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Yutulduğunda zararlı. Cilt ve göz tahrişine neden olur. |
| BM kimlik numaraları | Düzenlenmemiş |
| HS kodu | 2833.29.00 |
| Tehlike sınıfı | (EC) No 1272/2008 [CLP] Yönetmeliğine göre tehlikeli madde veya karışım olarak sınıflandırılmamıştır. |
| Paketleme grubu | Uygulanamaz |
| Toksisite | LD50 (oral, sıçan): > 2000 mg/kg |
Kalsiyum sülfat sentez yöntemleri
Çeşitli yöntemler, bileşiğin istenen formuna ve hidrasyon durumuna bağlı olarak CaSO4’ün sentezlenmesine izin verir.
Yaygın bir yöntem, kalsiyum karbonatın veya kalsiyum oksidin sülfürik asitle reaksiyona sokulmasıdır. Reaksiyon sırasıyla CaSO4 ve karbondioksit veya su üretir.
Başka bir yöntem, kalsiyum klorürün sodyum sülfatla reaksiyonunu içerir ve bunun sonucunda CaSO4 çökelir. CaSO4 dihidratın doğal bir mineral formu olan alçıtaşının termal dehidrasyonu, CaSO4 üretir.
Enerji santrali baca gazı kükürt giderme gibi bazı endüstriyel işlemler, yan ürün olarak CaSO4 üretir. Bu işlem sırasında kükürt dioksit, kalsiyum karbonatla reaksiyona girerek kalsiyum sülfit oluşturur ve bu da CaSO4 üretmek üzere oksidasyona uğrar.
CaSO4 için kullanılan sentez yöntemi parçacık boyutu, kristallik ve saflık gibi özelliklerini etkileyebilir. Bu nedenle bileşiğin amaçlanan uygulamasına uygun yöntemin seçilmesi önemlidir.
Kalsiyum Sülfatın Kullanım Alanları
CaSO4, düşük toksisite, yüksek erime noktası ve beyaz renk gibi benzersiz özellikleri nedeniyle farklı endüstrilerde birçok kullanıma sahiptir. CaSO4’ün bazı yaygın kullanımları şunlardır:
- İnşaat: Bağlayıcı ve macun görevi gördüğü çimento ve alçı levhanın önemli bir bileşenidir.
- Yiyecek ve İçecek: Tofu üretiminde pıhtılaştırıcı olarak, bazı peynirlerde ve konserve sebzelerde ise sıkılaştırıcı madde olarak kullanılır.
- İlaç: Tablet ve kapsül üretiminde dolgu ve bağlayıcı olarak kullanılır.
- Tarım: Toprak yapısını iyileştirmek ve ürün verimini artırmak için toprak düzenleyici olarak kullanılır.
- Kimyasallar: Pigmentler, kağıt ve tekstil işleme gibi çeşitli kimyasalların üretiminde kullanılır.
- Kozmetik: Kozmetik formülasyonlarda hacim artırıcı ve opaklaştırıcı madde olarak kullanılır.
- Su Arıtma: Kirlilikleri gidermek ve tortuyu azaltmak için su arıtımında kullanılır.
- Plastik ve Kauçuk: Plastik ve kauçuk ürünlerde dolgu ve takviye maddesi olarak kullanılır.
Sorular:
Soru: Kalsiyum sülfat vegan mıdır?
C: Evet, CaSO4 hayvansal kaynaklardan gelmediği için vegan olarak kabul ediliyor.
S: Hastanelerde kalsiyum sülfatın ana kullanımı neydi?
C: CaSO4 hastanelerde kemik kırıkları için alçı olarak yaygın olarak kullanılıyordu.
S: Kalsiyum sülfat ve fosforun kütleleri nelerdir?
C: Bu soru eksiktir ve spesifik bir cevap verebilmek için daha fazla bilgi gerektirir.
Soru: CaSO4 suda çözünür mü?
C: CaSO4’ün suda çözünürlüğü düşük olup, oda sıcaklığında çözünürlüğü yaklaşık 2,05 g/L’dir.
S: CaSO4 çözünür mü?
C: Kalsiyum sülfatın suda çözünürlüğü düşük olup, oda sıcaklığında çözünürlüğü yaklaşık 2,05 g/L’dir.
S: CaSO4’ün molar kütlesi nedir?
C: CaSO4’ün molar kütlesi yaklaşık 136,14 g/mol’dür.
Soru: Hangi tuzun pH’ı <7’dir? KBr, HCOOK, CaSO4, NH4NO3
C: Listelenen tuzların hiçbirinin saf formunda pH değeri < 7 değildir. Ancak suda çözündüğünde NH4NO3 (amonyum nitrat) pH’ı <7 olan asidik bir çözelti üretecektir.
