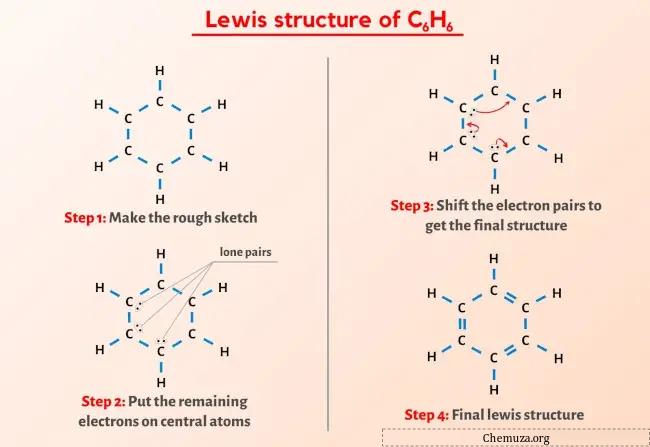
Yukarıdaki görseli zaten gördünüz değil mi?
Yukarıdaki görseli kısaca açıklayayım.
C6H6 (benzen) Lewis yapısı halka şeklinde bir yapıda 6 karbon (C) atomuna sahiptir ve her karbon atomu 1 hidrojen (H) atomuna bağlıdır. Karbonun (C) halka yapısında alternatif çift bağlar vardır.
C6H6’nın Lewis yapısının yukarıdaki görüntüsünden hiçbir şey anlamadıysanız, benimle kalın ve C6H6’nın Lewis yapısının nasıl çizileceğine dair ayrıntılı adım adım açıklamayı alacaksınız.
O halde C6H6’nın (benzen) Lewis yapısını çizme adımlarına geçelim.
C6H6 Lewis Yapısının Çizimindeki Adımlar
Adım 1: C6H6 molekülündeki toplam değerlik elektronu sayısını bulun
Bir C6H6 molekülündeki değerlik elektronlarının toplam sayısını bulmak için öncelikle hidrojen atomunun yanı sıra karbon atomunda bulunan değerlik elektronlarını bilmeniz gerekir.
(Değerlik elektronları herhangi bir atomun en dış yörüngesinde bulunan elektronlardır.)
Burada size periyodik tabloyu kullanarak hem karbonun hem de hidrojenin değerlik elektronlarını nasıl kolayca bulacağınızı anlatacağım.
C6H6 molekülündeki toplam değerlik elektronları
→ Karbon atomunun verdiği değerlik elektronları:
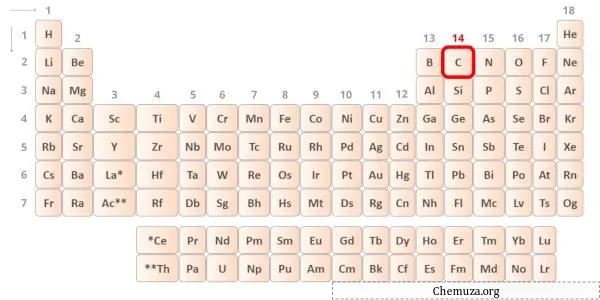
Karbon periyodik tablonun 14. grubunda yer alan bir elementtir. [1] Bu nedenle karbonda bulunan değerlik elektronları 4’tür .
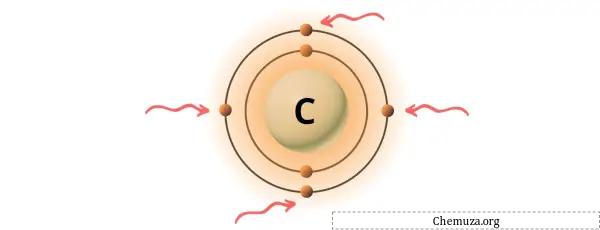
Yukarıdaki resimde gösterildiği gibi karbon atomunda bulunan 4 değerlik elektronunu görebilirsiniz.
→ Hidrojen atomunun verdiği değerlik elektronları:
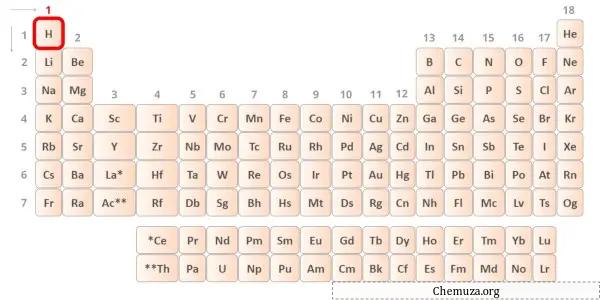
Hidrojen periyodik tablonun 1. grup elementidir. [2] Bu nedenle hidrojende bulunan değerlik elektronu 1’dir .

Yukarıdaki resimde gösterildiği gibi hidrojen atomunda yalnızca bir değerlik elektronunun bulunduğunu görebilirsiniz.
Bu yüzden,
C6H6 molekülündeki toplam değerlik elektronları = 6 karbon atomu tarafından bağışlanan değerlik elektronları + 6 hidrojen atomu tarafından bağışlanan değerlik elektronları = 4(6) + 1(6) = 30 .
Adım 2: Taslağı hazırlayın
Benzenin (C6H6) Lewis yapısı, halka yapısında düzenlenmiş 6 karbon atomuna sahiptir.
Ayrıca bu karbon atomlarının her biri 1 hidrojen atomuyla ilişkilidir.
Şimdi 6 karbon atomu ve her bir karbona bağlı hidrojen atomundan oluşan halkayı temsil eden taslağı çizelim.
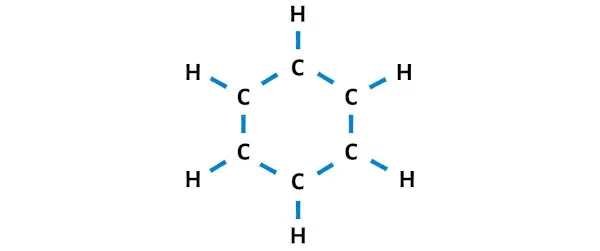
Yukarıdaki çizimde 12 adet tekli bağ bulunmaktadır. Yani yukarıdaki diyagramda toplam 30 değerlik elektronundan 24 değerlik elektronu kullanılmıştır.
Adım 3: Kalan elektronları merkez atomda tutun
1. adımda C6H6 molekülünde bulunan toplam değerlik elektronu sayısını hesapladığımızı görebilirsiniz.
C6H6 molekülünün toplam 30 değerlik elektronu vardır ve yukarıdaki diyagramda bunlardan sadece 24 değerlik elektronu kullanılmıştır.
Yani kalan elektron sayısı = 30 – 24 = 6 .
Bu 6 elektronu (yani 3 elektron çiftini ) C6H6 molekülünün yukarıdaki diyagramındaki karbon atomlarının üzerine yerleştirmeniz gerekiyor.
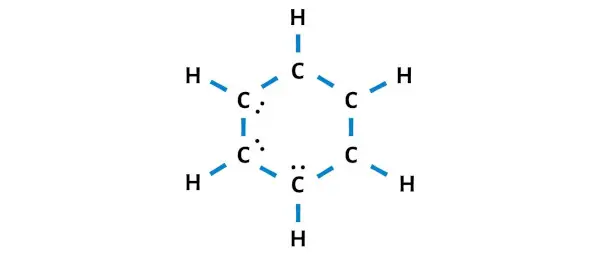
Şimdi bir sonraki adıma geçelim.
Adım 4: Tüm Atomları Kararlı Hale Getirin
Yukarıdaki çizimden dıştaki hidrojen atomlarının bir ikili oluşturduğunu görebilirsiniz. Bu nedenle kararlıdırlar.
Şimdi, 6 karbon atomundan üç karbon atomu bir oktet oluşturmaz.
Bu yüzden elektron çiftlerini, karbonun tamamı bir oktet oluşturacak ve kararlı hale gelecek şekilde hareket ettirmemiz gerekiyor.
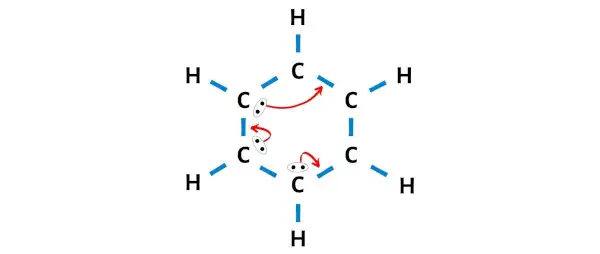
Elektron çiftlerini hareket ettirdikten sonra 6 karbon atomunun bir oktet oluşturduğunu ve artık kararlı olduklarını görebilirsiniz.
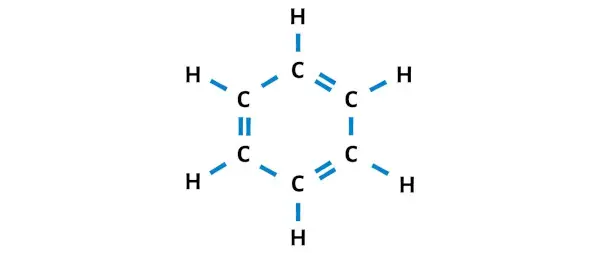
Bu nedenle benzenin (veya C6H6) kararlı Lewis yapısı budur.
Umarım yukarıdaki tüm adımları tamamen anlamışsınızdır.
Daha fazla pratik yapmak ve daha iyi anlamak için aşağıda listelenen diğer Lewis yapılarını deneyebilirsiniz.
Daha iyi anlamak için şu Lewis yapılarını deneyin (veya en azından görün):
