Bütan (C₄H₁₀) oldukça yanıcı bir hidrokarbon gazıdır. Verimli yanma özelliği ve taşınabilirliği nedeniyle çakmak ve kamp sobalarında yakıt olarak yaygın olarak kullanılır.
| IUPAC Adı | Bütan |
| Moleküler formül | C₄H₁₀ |
| CAS numarası | 106-97-8 |
| Eş anlamlı | n-Bütan, bütil hidrit, metiletilmetan, dietil |
| InChI | InChI=1S/C4H10/c1-3-4-2/h3-4H2.1-2H3 |
Bütanın özellikleri
Bütan formülü
Bütanın formülü C₄H₁₀’dir; bu, onun dört karbon atomu ve on hidrojen atomundan oluştuğunu gösterir. Formül, bütanın kimyasal bileşimi hakkında değerli bilgiler sağlayarak bilim adamlarının özelliklerini ve davranışını incelemesine olanak tanır.
Bütan Molar Kütlesi
Bütil hidrürün molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanabilir. Butil hidrit (C₄H₁₀) için molar kütle, mol başına yaklaşık 58,12 gramdır. Molar kütle, çeşitli kimyasal hesaplamalarda çok önemli bir parametredir ve bütil hidrürün fiziksel ve kimyasal özelliklerinin belirlenmesinde önemli bir rol oynar.
Bütanın kaynama noktası
Butil hidrit, -1°C (30°F) civarında nispeten düşük bir kaynama noktasına sahiptir. Bu, bu sıcaklıkta veya bu sıcaklığın üzerinde bütil hidrürün sıvı fazdan gaz fazına kolayca geçiş yaptığı anlamına gelir. Düşük kaynama noktası, bütil hidrürü çakmaklar ve portatif kamp ocakları gibi uygulamalar için ideal bir yakıt haline getirir.
Bütan Erime Noktası
Butil hidrürün erime noktası yaklaşık -138,4°C’dir (-217,12°F). Bu sıcaklıkta veya altında katı bütil hidrit faz değişimine uğrar ve sıvı hale gelir. Ancak normal atmosferik koşullar altında bütil hidrür genellikle gaz halinde bulunur.
Bütan yoğunluğu g/mL
Butil hidrürün yoğunluğu mililitre başına yaklaşık 2,48 gramdır. Bu, bütil hidrürün yoğunluğu 1 g/mL olan sudan daha hafif olduğunu gösterir. Bütil hidrürün yoğunluğu, yanma özelliklerinin yanı sıra depolama veya taşıma sırasındaki davranışını belirleyen çok önemli bir özelliktir.
Bütan Molekül Ağırlığı
Butil hidrürün moleküler ağırlığı mol başına yaklaşık 58.12 gramdır. Tek bir bütil hidrit molekülündeki tüm atomların atom ağırlıklarının toplamını temsil eder. Molekül ağırlığı, çeşitli bilimsel hesaplamalar için önemli bir parametredir ve bütil hidrürün özelliklerinin ve davranışının anlaşılmasına yardımcı olur.
Bütanın yapısı
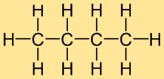
Bütil hidrürün yapısı, on hidrojen atomunun bağlı olduğu dört karbon atomundan oluşan düz bir zincirden oluşur. Karbon atomları sürekli bir çizgi halinde düzenlenmiştir ve her karbon atomu, iki komşu karbon atomu ve üç hidrojen atomuyla tekli bağlar oluşturur. Bu doğrusal yapı, bütil hidrürün fiziksel ve kimyasal özelliklerine katkıda bulunur.
Bütanın çözünürlüğü
Butil hidrürün suda nispeten çözünmez olduğu kabul edilir. Polar olmayan yapısı ve su molekülleri ile moleküller arası zayıf etkileşimleri nedeniyle düşük çözünürlük sergiler. Bununla birlikte bütil hidrit, etanol ve aseton gibi organik çözücülerde oldukça çözünür. Bu çözünürlük davranışı, ekstraksiyon prosesleri ve solvent bazlı reaksiyonlar gibi çeşitli uygulamalarda önemlidir.
| Dış görünüş | Renksiz gaz |
| Spesifik yer çekimi | 2.48 |
| Renk | Yok |
| Koku | Kokusuz |
| Molar kütle | 58,12 gr/mol |
| Yoğunluk | 2.48g/ml |
| Füzyon noktası | -138,4°C (-217,12°F) |
| Kaynama noktası | -1°C (30°F) |
| Flaş noktası | -60°C (-76°F) |
| sudaki çözünürlük | Çözünmez |
| çözünürlük | Organik çözücülerde çözünür |
| Buhar basıncı | 20°C’de 2,4 ATM |
| Buhar yoğunluğu | 2,07 (hava = 1) |
| pKa | Yok |
| pH | Yok |
Bütan Güvenliği ve Tehlikeleri
Butil hidrit, dikkate alınması gereken bazı güvenlik riskleri taşır. Oldukça yanıcı bir gazdır ve bir ateşleme kaynağının varlığında kolayca tutuşabilir. Kazara yangın veya patlamayı önlemek için önlemler alınmalıdır. Yanıcı buharların birikmesini önlemek için bütil hidrürün iyi havalandırılan alanlarda depolanması ve taşınması önemlidir. Bütil hidrürün doğrudan solunması zararlı olabilir çünkü oksijenin yerini alır ve boğulmaya neden olabilir. Ek olarak, yüksek konsantrasyonlarda bütil hidrüre maruz kalmak baş dönmesine, uyuşukluğa ve mide bulantısına neden olabilir. Uygun şekilde tasarlanmış ve onaylanmış ekipmanlarda bütil hidrit kullanılması ve açık alev veya kıvılcımlarla temastan kaçınılması gibi uygun güvenlik önlemlerinin takip edilmesi önemlidir.
| Tehlike sembolleri | Yanıcı gaz |
| Güvenlik Açıklaması | Açık alev ve kıvılcımlardan uzak tutun. İyi havalandırılmış bir alanda saklayın. Teneffüs etmekten ve doğrudan temastan kaçının. |
| Birleşmiş Milletler tanımlayıcıları | BM 1011 |
| HS kodu | 2711.12.20 |
| Tehlike sınıfı | Sınıf 2.1 (Yanıcı gaz) |
| Paketleme grubu | Paketleme grubu II |
| Toksisite | Butil hidrürün genellikle düşük toksisiteye sahip olduğu kabul edilir. Ancak yüksek konsantrasyonların solunması baş dönmesine, uyuşukluğa ve mide bulantısına neden olabilir. Ayrıca kapalı alanlardaki oksijenin yerini alarak boğulmaya neden olabilir. Güvenliği sağlamak için uygun havalandırma ve taşıma prosedürleri takip edilmelidir. |
Bütan Sentezi Yöntemleri
Çeşitli yöntemler, esas olarak petrol veya doğal gaz üretimini içeren bütil hidrürü sentezler.
Fraksiyonel Damıtma: Ham petrol veya petrolün fraksiyonel damıtılması sırasında, işlem bir yan ürün olarak bütil hidrit üretir. Rafinasyon işlemi, farklı hidrokarbon fraksiyonlarını kaynama noktalarına göre ayırır ve bütil hidrit, izole edilebilecek bileşenlerden biridir.
Doğal gaz işleme: Doğal gaz işleme aynı zamanda bütil hidrit de üretir. Doğal gaz, metan dahil olmak üzere çeşitli hidrokarbonlar ve bütil hidrit gibi daha yüksek hidrokarbonlar içerir. Doğal gaz karışımı, bütil hidrürün ayrılması için absorpsiyon veya kriyojenik ayırma gibi işlemlere tabi tutulur.
Hidrokarbon çatlaması: Kırma işlemi, daha büyük hidrokarbon zincirlerini daha küçük zincirlere bölerek bütil hidrit üretir. Bu, daha ağır hidrokarbonların yüksek sıcaklıklara maruz bırakılmasını veya bir ürün olarak bütil hidrürün üretilmesi için katalizörlerin kullanılmasını içerir.
İzomerizasyon: İzomerizasyon, hidrokarbonların moleküler yapısını yeniden düzenleyerek pentan veya heksan gibi diğer hidrokarbonları izomerlerine izomerleştirerek bütil hidrürün sentezine izin verir. Spesifik katalizörler bu prosesi uygun koşullar altında katalize eder.
Sentez Süreci: Laboratuvarda bilim adamları, bütil hidrürü sentetik yollarla sentezleyebilirler. Öncü bileşiklerden bütil hidrit üretmek için hidrojenasyon veya indirgeme gibi çeşitli kimyasal reaksiyonları kullanabilirler.
Bu yöntemler, küçük ölçekli laboratuvarların yanı sıra büyük ölçekli endüstriyel işlemlerde de bütil hidrürün üretilmesini mümkün kılmaktadır. Yöntemin seçimi ham maddelerin mevcudiyetine, istenen saflığa ve uygulamanın özel gereksinimlerine bağlıdır.
Bütanın Kullanım Alanları
Butil hidrit, faydalı özellikleri nedeniyle çeşitli endüstrilerde ve günlük kullanımda uygulama alanı bulmaktadır. Bütil hidrürün bazı yaygın kullanımları şunlardır:
- Yakıt: Butil hidrit, yüksek enerji içeriği ve verimli yanma özellikleri sayesinde taşınabilir sobalara, kamp ısıtıcılarına ve çakmaklara yakıt olarak güç sağlar.
- Aerosol İtici Gaz: Butil hidrit, saç spreyleri, oda spreyleri ve aerosol boyalar gibi aerosol ürünlerini iterek bunların ince bir sis veya sprey olarak salınmasına olanak tanır.
- Soğutucu akışkan: Bütil hidrit, ev tipi buzdolapları ve dondurucular gibi küçük ölçekli soğutma sistemlerini soğutur ve düşük sıcaklıkları korur ve soğutucu akışkan görevi görür.
- Çakmak Sıvısı: Bütil hidrit, sigara çakmaklarına ve meşale çakmaklarına güç vererek, çakmak sıvılarının önemli bir bileşeni olan bir alev üretir.
- Ekstraksiyon: Butil hidrit, uçucu yağların ve bitki bileşiklerinin botanik malzemelerden ekstraksiyonunda bir çözücü görevi görür ve istenen bileşikleri etkili bir şekilde çözer.
- Laboratuvar kullanımı: Laboratuvarlar, Bunsen brülörleri ve gaz kromatografisi için yakıt olarak bütil hidrit kullanır.
- Kalibrasyon gazı: Bütil hidrit, gaz dedektörleri ve sensörleri için iyi tanımlanmış ve kolayca ölçülen özellikler sağlayan bir kalibrasyon gazı görevi görür.
- Kaynak ve lehimleme: Bütil hidrit torçlar, yüksek sıcaklıkları, hassasiyetleri ve kullanım kolaylığı sayesinde kaynak ve sert lehimleme işlemlerini kolaylaştırır.
- Rekreasyon: Butil hidrit, taşınabilir kamp ocaklarına ve el fenerlerine güç vererek kamp, yürüyüş ve yemek pişirme gibi açık hava eğlence aktivitelerini geliştirir.
- Tüketim Kaynağı: Butil hidrit, ısıtma araçları, küçük ısıtıcılar ve belirli endüstrilerdeki alev bazlı uygulamalar dahil olmak üzere çeşitli uygulamalarda ısı kaynağı olarak hizmet eder.
Bütil hidrürün çok yönlü doğası ve uygulama yelpazesi, onu çeşitli endüstrilerde, ev eşyalarında ve eğlence faaliyetlerinde değerli bir bileşik haline getirmektedir.
Soru:
S: Yakınımdaki bütan gazını nereden satın alabilirim?
C: Bütil hidrit gazını genellikle yerel hırdavat mağazalarında, süpermarketlerde veya kamp malzemeleri satan marketlerde bulabilirsiniz.
Soru: Bütan gazı doğal gaz mıdır?
C: Hayır, butil hidrit doğal gaz sayılmaz. Petrol veya doğal gazın işlenmesinden elde edilen bir hidrokarbon gazıdır.
S: Bütan nedir?
C: Butil hidrit, C₄H₁₀ kimyasal formülüne sahip gaz halinde bir hidrokarbondur. Yaygın olarak yakıt olarak ve çeşitli uygulamalarda kullanılan renksiz ve kokusuz yanıcı bir gazdır.
S: Bütan nasıl yapılır?
C: Bütil hidrit öncelikle petrol veya doğal gazın ayrımsal damıtılması, daha ağır hidrokarbonların parçalanması veya diğer hidrokarbonların izomerleştirilmesi gibi işlemlerle üretilir.
S: Bütan çakmağını nasıl yeniden doldurabilirim?
C: Bir bütil hidrit çakmağı doldurmak için öncelikle genellikle alt kısımdaki yeniden doldurma valfini bulun. Bütil hidrit memesini valfin içine yerleştirin ve bütil hidrürün lümen içine dolana kadar serbest bırakılması için sıkıca bastırın.
Soru: Aşağıdaki bileşiklerden hangisi bütanın yapısal izomeridir?
C: Pentan (C₅H₁₂), bütil hidrürün yapısal bir izomeridir, çünkü her iki bileşik de dört karbon atomu içerir ancak farklı düzenlemelere sahiptir.
S: Bütan çakmağını nasıl yeniden doldurabilirim?
C: Bir bütil hidrit çakmağı yeniden doldurmak için, çakmağı baş aşağı tutun, bütil hidrit yeniden doldurma kartuşunun memesini çakmağın yeniden doldurma valfiyle hizalayın ve hidrürü bütilden çakmağa serbest bırakmak için kartuşa sıkıca bastırın.
S: Yakınımdaki bütanı nereden satın alabilirim?
C: Bütil hidriti yerel hırdavat mağazalarından, süpermarketlerden veya kamp malzemeleri veya ev eşyaları satan marketlerden satın alabilirsiniz.
S: Bütan nereden alınır?
C: Butil hidrit, çevrimiçi perakendeciler, hırdavat mağazaları, kamp malzemeleri mağazaları ve bazı süpermarketler dahil olmak üzere çeşitli kaynaklardan satın alınabilir.
S: Hangi ifade bütanın (C₄H₁₀) erime noktasını oktanın (C₈H₁₈) erime noktasıyla en iyi şekilde karşılaştırır?
C: Daha büyük ve daha karmaşık bir moleküler yapıya sahip olan oktan, genellikle bütil hidritten daha yüksek bir erime noktasına sahiptir.
S: Bütanın molar kütlesi (C₄H₁₀) nedir?
C: Butil hidrürün (C₄H₁₀) molar kütlesi mol başına yaklaşık 58,12 gramdır.
S: C₄H₁₀ için kaç izomer mümkündür?
C: Butil hidrürün (C₄H₁₀) iki izomeri vardır: n-bütan (normal bütan) ve izobütan (2-metilpropan).
S: C₄H₁₀, SrCl₂, Cr(NO₃)₃, OF₂ bileşiklerinden hangileri molekül olarak bulunmalıdır?
A: C₄H₁₀ (butil hidrit) ve OF₂’nin (oksijen diflorür) moleküller halinde mevcut olması beklenirken, SrCl₂ ve Cr(NO₃)₃ iyonik bileşiklerdir.
