Bor oksit (B2O3), bor ve oksijenin kimyasal bağıyla oluşan bir bileşiktir. Yüksek erime noktası nedeniyle cam ve seramik üretiminde kullanılır.
| IUPAC Adı | Bor oksit |
| Moleküler formül | B2O3 |
| CAS numarası | 1303-86-2 |
| Eş anlamlı | Triboron trioksit, borik oksit, bor(III) oksit |
| InChI | InChI=1S/B2O3/c3-1-5-2(4)6-1 |
Bor oksitin özellikleri
Bor Oksit Formülü
Borik oksitin kimyasal formülü B2O3’tür. Bileşikteki bor atomlarının oksijen atomlarına oranını temsil eder. İndeks numaraları, her borik oksit molekülünde iki bor atomu ve üç oksijen atomunun mevcut olduğunu gösterir.
Bor Oksit Molar Kütlesi
Borik oksidin molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanabilir. Borun atom kütlesi 10,81 g/mol, oksijenin atom kütlesi ise 16,00 g/mol’dür. Atom kütleleri ilgili atom sayısıyla çarpılıp toplandığında borik oksidin molar kütlesi 69,62 g/mol olarak belirlenir.
Bor oksitin kaynama noktası
Borik oksit, yaklaşık 1.860 santigrat derecelik yüksek bir kaynama noktasına sahiptir. Bu, normal atmosferik basınçta borik oksidi sıvı halinden gaz haline dönüştürmenin önemli miktarda enerji gerektirdiği anlamına gelir.
Bor oksitin erime noktası
Borik oksitin erime noktası yaklaşık 450 santigrat derecedir. Bu sıcaklıkta katı borik oksit sıvı duruma geçer. Nispeten düşük erime noktası onu çeşitli endüstriyel uygulamalar için uygun kılar.
Bor oksit yoğunluğu g/mL
Borik oksitin yoğunluğu yaklaşık 2,46 g/mL’dir. Yoğunluk, bir maddenin birim hacmi başına kütlesini ifade eder. Borik oksitin yoğunluğu, onun nispeten yoğun olduğunu ve çoğu sıvıda akmasına izin verdiğini gösterir.
Bor oksidin moleküler ağırlığı
Molar kütle olarak da adlandırılan borik oksidin moleküler ağırlığı 69,62 g/mol’dür. Bu değer bileşiğin bir molünün kütlesini temsil eder ve belirli bir numunedeki borik oksit miktarının hesaplanmasında faydalıdır.
Bor oksidin yapısı
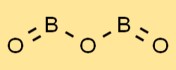
Borik oksit, bir dizi trigonal düzlemsel BO3 birimi içeren benzersiz bir yapıya sahiptir. Bor atomları üçgen şeklinde düzenlenmiş üç oksijen atomu ile çevrilidir. Bu düzenleme borik okside karakteristik özelliklerini ve stabilitesini verir.
Bor oksidin çözünürlüğü
Borik oksit suda ve çoğu organik çözücüde çözünmez. Sülfürik asit ve hidroklorik asit gibi asitlerde çözünürlüğü sınırlıdır. Bu düşük çözünürlük, cam ve seramik üretimi gibi çeşitli uygulamalardaki stabilitesine ve kullanışlılığına katkıda bulunur.
| Dış görünüş | Beyaz katı |
| Spesifik yer çekimi | 2,46 gr/ml |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 69,62 gr/mol |
| Yoğunluk | 2,46 gr/ml |
| Füzyon noktası | 450°C |
| Kaynama noktası | 1860°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çözünmez |
| çözünürlük | Sülfürik asit ve hidroklorik asit gibi asitlerde sınırlı çözünürlük |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Uygulanamaz |
Parlama noktası, buhar basıncı, buhar yoğunluğu, pKa ve pH gibi bazı özelliklerin borik oksit için geçerli olmadığını veya rapor edilmediğini lütfen unutmayın.
Bor oksitin güvenliği ve tehlikeleri
Borik oksit belirli güvenlik ve tehlike hususlarını beraberinde getirir. Borik oksit tozu veya tozuyla doğrudan temas cildi, gözleri ve solunum sistemini tahriş edebilir. Dikkatli bir şekilde kullanılması ve eldiven ve gözlük gibi uygun kişisel koruyucu ekipmanların kullanılması önemlidir. Borik oksit parçacıklarının solunması solunum yolu tahrişine neden olabilir, bu nedenle iyi havalandırılan alanlarda çalışılması tavsiye edilir. Yanlışlıkla yutulması durumunda derhal tıbbi yardıma başvurulmalıdır. Borik oksit yanıcı değildir ve parlama noktası yoktur. Herhangi bir kimyasal maddede olduğu gibi, güvenli kullanımın sağlanması için uygun kullanım ve depolama kurallarına uyulması tavsiye edilir.
| Tehlike sembolleri | sınıflandırılmamış |
| Güvenlik Açıklaması | Cilt ve gözlerle temasından kaçının. İyi havalandırılan bir ortamda kullanınız. Koruyucu ekipman giyin. |
| BM kimlik numaraları | Uygulanamaz |
| HS kodu | 2810.00.2000 |
| Tehlike sınıfı | sınıflandırılmamış |
| Paketleme grubu | Uygulanamaz |
| Toksisite | Düşük ila orta derecede toksisite. Temas veya solunması halinde tahrişe neden olabilir. |
Borik oksitin tehlike sembolleri, BM tanımı, tehlike sınıfı veya paketleme grubu taşımadığını lütfen unutmayın. Maruz kalma riskini en aza indirmek ve güvenli kullanımı sağlamak için borik oksitle çalışırken ve kullanırken genel güvenlik kurallarına ve uygulamalarına uymak önemlidir.
Bor oksit sentezi için yöntemler
Çeşitli yöntemler borik oksit sentezine izin verir. Yaygın olarak kullanılan bir yaklaşım, borik oksit oluşturmak için elemental borun oksijen veya hava varlığında ısıtılmasıdır. Başka bir yöntem, bor triklorür (BCl3) veya bor tribromür (BBr3) gibi bor halojenürlerin su ile reaksiyona sokulmasını ve bunun sonucunda borik oksit oluşumunu içerir.
Ek olarak bor nitrür veya bor trisülfür gibi bor içeren bileşikler, borik oksit üretmek için su ile hidrolize tabi tutulabilir. Sodyum borat veya boraks gibi boratların ısıya maruz kaldığında termal ayrışması da borik oksit üretir.
Spesifik bir sentez yönteminin seçiminin borik oksidin istenen saflığına, miktarına ve uygulamasına bağlı olduğunu belirtmek önemlidir. Her yöntemin avantajları vardır ve farklı durumlara uygun olabilir.
Bor oksit kullanımları
Borik oksit çeşitli endüstrilerde çeşitli uygulamalar bulur. İşte bazı kullanımları:
- Cam ve seramik üretimi: Borik oksit, cam ve seramik üretiminde önemli bir bileşendir. Cam ürünlere ısıya dayanıklılık, şeffaflık ve dayanıklılık gibi arzu edilen özellikleri kazandırır.
- Alev Geciktiriciler: Üreticiler tekstil, plastik ve ahşap ürünler gibi malzemelerde alev geciktirici olarak borik oksit kullanır. Borik oksit bu malzemelerin yanıcılığını azaltarak güvenliğin artmasını sağlar.
- Borosilikat Cam: Borik oksit, düşük termal genleşmesi ve yüksek ısı direnciyle bilinen borosilikat camın bir bileşeni olarak hayati bir rol oynar. Endüstriler bu tür camları laboratuvar ekipmanlarında, mutfak eşyalarında ve ileri teknoloji optik cihazlarda kullanır.
- Özel elyaflar: Bor elyafları ve bor nitrür elyafları dahil olmak üzere özel elyafların üretimi, borik oksit kullanımını içerir. Bu elyaflar olağanüstü mekanik ve termal özelliklere sahiptir ve bu da onları havacılık, otomotiv ve yüksek teknoloji endüstrileri için uygun hale getirir.
- Bor Kimyasalları: Borik oksit, boratlar ve bor hidrürler gibi çeşitli bor kimyasallarının sentezi için bir öncü görevi görür. Bu kimyasallar tarım, ilaç ve enerji depolama sistemlerinde uygulama alanı bulmaktadır.
- Lehimleme Fluxları ve Ajanları: Borik oksit, malzemelerin erime noktasını düşürür ve akışkanlığını arttırır, bu da onu metalurjik proseslerde etkili bir fluks haline getirir. Lehimleme maddesi olarak kullanıldığında metal yüzeylerin yapışmasını iyileştirir.
- Katalizörler: Kimyasal reaksiyonlar borik oksit katalizörlerinden yararlanır çünkü istenen reaksiyonları teşvik ederler ve reaksiyon hızlarını arttırırlar.
- Yarı İletken Endüstrisi: Borik oksit, yarı iletkenlerin üretiminde çok önemli bir rol oynar. Silikonun elektriksel özelliklerini aktif olarak değiştirmek için katkı maddesi görevi görür.
Borik oksitin geniş uygulama yelpazesi, çeşitli endüstrilerdeki çok yönlülüğünü ve önemini vurgulayarak teknoloji, güvenlik ve malzeme bilimindeki ilerlemelere katkıda bulunur.
Sorular:
S: B2O3’teki borun oksidasyon durumu nedir?
C: B2O3’teki borun oksidasyon durumu +3’tür.
S: Bor oksidin ampirik formülü nedir?
A: Borik oksidin ampirik formülü B2O3’tür.
S: Borun yüzey konsantrasyonu oksidin büyüme hızını ne zaman etkileyecektir?
C: Borun yüzey konsantrasyonu, oksidasyon sürecinde katkı maddesi veya katalizör görevi gördüğünde oksidin büyüme hızını etkileyecektir.
S: Boria Bor Oksit Nedir?
C: Boria olarak da bilinen borik oksit, B2O3 kimyasal formülüne sahip bir bileşiktir.
Soru: Borun oksidasyon numarası nedir?
C: Borun genellikle +3 oksidasyon numarası vardır.
S: Bor, oksijenden yoksun malzemelerde oksidasyonu yavaşlatır mı?
C: Bor, oksijenden yoksun malzemelerde oksidasyonu yavaşlatmaz çünkü borik oksit oluşturmak için oksijene ihtiyaç duyar.
S: CuO’daki HBO2’deki borun oksidasyon durumu nedir?
C: HBO2’deki borun oksidasyon durumu +3’tür.
Soru: Kaç mol B2O3 oluşturulabilir?
C: Oluşan B2O3’ün mol sayısı reaksiyonda kullanılan reaktanların miktarına bağlıdır.
S: B2O3 iyonik mi yoksa moleküler mi?
Cevap: B2O3 iyonik bir bileşiktir.
S: Hangi çift artan baziklik sırasına göre listelenmiştir? PBO < SiO2 B2O3 < Li2O
C: Artan baziklik sırasına göre listelenen çift B2O3 < Li2O < PBO < SiO2’dir.
Soru: B2H6 + O2 → B2O3 + H2O, bu denklem dengeli mi?
C: Hayır, denklem dengeli değil. Bu, dengeli bir denklem elde etmek için ayarlamalar gerektirir.
S: 210,0 pound B2O3’ten ne kadar bor elde edebilirsiniz?
C: 210,0 pound B2O3’ten elde edilen bor miktarı reaksiyonun molar kütlesine ve stokiyometrisine bağlıdır.
