Bakır nitrat (Cu(NO3)2), çeşitli endüstrilerde kullanılan mavi kristalli bir bileşiktir. Kimyasal işlemlerde bakır malzemeler için katalizör, oksitleyici madde ve öncü olarak görev yapar.
| IUPAC Adı | Bakır(II) nitrat |
| Moleküler formül | Cu(NO3)2 |
| CAS numarası | 3251-23-8 |
| Eş anlamlı | Bakır nitrat; Bakır nitrat; Bakır nitrat; Nitrik asit, bakır tuzu (2+) |
| InChI | InChI=1S/2NO3.Cu/c2 2-1(3)4;/q2 -1;+2 |
Bakır nitratın özellikleri
Bakır Nitrat Formülü
Bakır nitratın kimyasal formülü Cu(NO3)2’dir. Bu, her bakır nitrat molekülünün bir bakır iyonu (Cu) ve iki nitrat iyonu (NO3) içerdiğini gösterir. Bakır(II) iyonlarının varlığı bakırın +2 oksidasyon durumunu gösterir.
Bakır Nitrat Molar Kütlesi
Bakır nitratın molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanabilir. Bakırın (Cu) molar kütlesi yaklaşık 63,55 g/mol iken nitratın (NO3) molar kütlesi yaklaşık 62,00 g/mol’dür. Yani bakır nitratın molar kütlesi yaklaşık 187,55 g/mol’dür.
Bakır nitratın kaynama noktası
Bakır nitratın kaynama noktası, standart atmosferik basınç altında sıvıdan gaza dönüştüğü sıcaklığı ifade eder. Bakır nitratın kaynama noktası genellikle 100°C’nin (212°F) üzerindedir. Ancak bakır nitratın genellikle kaynama noktasına ulaşmadan ayrıştığını unutmamak önemlidir.
Bakır nitratın erime noktası
Bakır nitratın erime noktası, katı halden sıvı duruma geçtiği sıcaklıktır. Bakır nitratın erime noktası genellikle 256°C ile 260°C (493°F ile 500°F) arasındadır. Bu maddenin ayrışmasını önlemek için dikkatli bir şekilde kullanılması önemlidir.
Bakır nitratın yoğunluğu g/mL
Bakır nitratın yoğunluğu birim hacim başına kütlesini ifade eder. Katı kuprik nitratın yoğunluğu genel olarak 2,32 g/mL civarında iken sulu çözeltilerinin yoğunluğu konsantrasyona bağlı olarak değişebilmektedir.
Bakır Nitrat Molekül Ağırlığı
Bakır nitratın moleküler ağırlığı, kimyasal formülündeki tüm atomların atom ağırlıklarının toplamıdır. Cu(NO3)2 için molekül ağırlığı yaklaşık 187,55 g/mol’dür.
Bakır nitratın yapısı
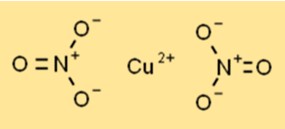
Bakır nitrat, altıgen kristal yapıya sahip mavi kristal bir katı olarak bulunur. Her bir bakır iyonu (Cu2+), iki nitrat iyonundan gelen altı oksijen atomu ile çevrelenerek koordineli bir düzenleme oluşturulur. Yapı, çeşitli kimyasal işlemlerde stabilitesine ve reaktivitesine katkıda bulunur.
Bakır nitratın çözünürlüğü
Bakır nitrat suda orta derecede çözünür. Suda çözündüğünde, elektrokaplama gibi çeşitli uygulamalarda ve kimyasal reaksiyonlarda reaktif olarak kullanılabilen sulu bir çözelti oluşturur. Ancak sıcaklık düştükçe çözünürlüğü azalır.
| Dış görünüş | Mavi kristal katı |
| Spesifik yer çekimi | Yok |
| Renk | Mavi |
| Koku | Kokusuz |
| Molar kütle | 187,55 gr/mol |
| Yoğunluk | 2,32 g/mL (katı) |
| Füzyon noktası | 256-260°C (493-500°F) |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Yok |
| sudaki çözünürlük | Orta derecede çözünür, sulu bir çözelti oluşturur |
| çözünürlük | Suda çözünebilir |
| Buhar basıncı | Yok |
| Buhar yoğunluğu | Yok |
| pKa | Yok |
| pH | Asit |
Bakır nitratın güvenliği ve tehlikeleri
Bakır nitrat belirli güvenlik ve tehlike endişeleri doğurur. Bu bileşiği dikkatli bir şekilde kullanmak önemlidir. Cilt veya gözlerle doğrudan temas tahrişe veya yanıklara neden olabilir. Toz veya dumanların solunması solunum yolu tahrişine neden olabilir. Isıtıldığında zehirli nitrojen oksitler açığa çıkarabilir. Bu madde aynı zamanda oksitleyici bir maddedir ve yanıcı maddeleri temas halinde tutuşturabilir. Bakır nitratla çalışırken eldiven ve gözlük gibi uygun koruyucu ekipmanlar kullanılmalıdır. Potansiyel riskleri en aza indirmek için yanıcı maddelerden ve uyumsuz maddelerden uzakta saklanmalıdır. Her zaman güvenlik talimatlarına uyun ve iyi havalandırılmış bir alanda kullanın.
| Tehlike sembolleri | Oksitleyici madde, Aşındırıcı, Tahriş edici |
| Güvenlik Açıklaması | Depozito ile işlem yapın. Cilt ve gözlerle temasından kaçının. İyi havalandırılan bir ortamda kullanınız. Yanıcı malzemelerden uzak tutun. |
| BM kimlik numaraları | UN3085 |
| HS kodu | 28342910 |
| Tehlike sınıfı | 5.1 (Oksitleyici madde) |
| Paketleme grubu | III |
| Toksisite | Yutulduğunda zararlı. Cilt ve göz tahrişine neden olabilir. Toz veya dumanların solunması solunum yolu tahrişine neden olabilir. |
Bakır nitrat sentez yöntemleri
Bakır nitratı sentezlemek için çeşitli yöntemler vardır.
Yaygın bir yaklaşım, bakır oksit (CuO) veya bakır hidroksit (Cu(OH)2) ile nitrik asit (HNO3) arasındaki reaksiyonu içerir. Kuprik nitrat hazırlanırken, nitrik asit çözeltisine yavaş yavaş bakır oksit veya bakır hidroksit eklenebilir, bu da bakır nitrat ve su oluşumuna yol açar.
Başka bir yöntem, metalik bakır (Cu) ile konsantre nitrik asit arasındaki reaksiyonu içerir. Cu metali nitrik asitle reaksiyona girerek bakır nitrat, nitrojen dioksit (NO2) ve su üretir. Bu yöntem zehirli nitrojen dioksit gazı oluşması nedeniyle dikkatli kullanım gerektirir.
Alternatif olarak, bakır nitrat üretmek için metalik bakırı veya bakır oksidi nitrik asit ve hidrojen peroksit (H2O2) karışımı içinde çözebilirsiniz. Bu yöntem daha hızlı reaksiyona olanak tanır ve saf bakır nitrat üretir.
Son olarak CuSO4 ile sodyum nitrat (NaNO3) arasındaki çift yer değiştirme reaksiyonu da bakır nitrat üretebilir. Bu iki tuzun suda karıştırılmasıyla bakır nitrat çöker ve yan ürün olan sodyum sülfat çözünmüş halde kalır.
İlgili kimyasallar reaktivite gösterdiğinden sentez sırasında güvenlik önlemlerini izleyin. Bakır nitratın başarılı ve güvenli sentezini sağlamak için uygun koruyucu ekipman kullanın ve uygun laboratuvar uygulamalarını kullanın.
Bakır nitratın kullanım alanları
Bakır nitrat, benzersiz özellikleri nedeniyle farklı endüstrilerde çeşitli uygulamalar bulur. Bazı dikkate değer kullanımlar şunları içerir:
- Katalizör: Organik sentezde katalizör görevi görerek alkollerin aldehitlere veya ketonlara dönüşümü gibi reaksiyonları kolaylaştırır.
- Piroteknik: Bakır nitrat, piroteknik formülasyonların önemli bir bileşenidir ve alevlerin mavi ve yeşil renklerine katkıda bulunur.
- Tarım: Tarımda bitkilere gerekli besin maddelerini sağlamak için gübrelerde bakır kaynağı olarak görev yapar.
- Oksitleyici madde: Bakır nitrat, kimyasal işlemler sırasında diğer maddeleri aktif olarak oksitler.
- Metal Kaplama: Bakır nitrat, elektrokaplama işlemleri sırasında çeşitli metal yüzeyler üzerinde aktif olarak ince bir Cu tabakası biriktirir.
- Pigmentler ve Boyalar: Bakır nitrat, seramik, cam ve tekstil ürünleri için yeşil ve mavi pigmentlerin oluşturulmasına aktif olarak katkıda bulunur.
- Fotoğrafik süreçler: bakır nitrat, belirli fotoğraf çözümlerinde görüntü gelişimine aktif olarak katkıda bulunur.
- Koruma: Koruyucuların sabitlenmesine yardımcı olarak ahşabın korunmasında uygulama alanı bulur.
- Diğer bakır bileşiklerinin hazırlanması: Çeşitli bakır bazlı malzeme ve bileşiklerin sentezinde öncü görevi görür.
Bakır nitratın çok yönlülüğü ve reaktivitesi, onu endüstriyel işlemlerden sanatsal uygulamalara kadar çeşitli alanlarda değerli bir kimyasal haline getirir.
Sorular:
S: Bakır nitrat ısıtıldığında ne olur?
C: Isıtıldığında bakır nitrat, bakır oksit, nitrojen dioksit gazı ve oksijene ayrışır.
Soru: Bakır nitrat suda çözünür mü?
C: Evet, bakır nitrat suda orta derecede çözünür.
S: Bakır nitratın kimyasal formülü nedir?
C: Bakır nitratın kimyasal formülü Cu(NO3)2’dir.
S: Bakır nitrat güçlü bir elektrolit midir?
C: Evet, kuprik nitrat, suda çözündüğünde iyonlara ayrışan güçlü bir elektrolittir.
Soru: Bakır nitratın yükü nedir?
A: Bakır nitratın net yükü 0’dır; nötr bir bileşiktir.
Soru: 10,2 g bakır(II) nitratta kaç tane nitrojen atomu vardır?
C: Yaklaşık 0,161 mol bakır(II) nitrat ve dolayısıyla yaklaşık 0,322 mol nitrojen atomu vardır.
Soru: 3,00 mol bakır ve 3,85 mol gümüş nitrattan ne kadar gümüş üretilebilir?
C: Dengeli kimyasal denklem takip edilerek 342,3 g gümüş üretilebilir.
Soru: Bakır nitrat çözünür mü?
C: Evet, bakır nitrat suda çözünür.
S: Bakır(II) nitratın formülü nedir?
C: Kuprik(II) nitratın formülü Cu(NO3)2’dir.
S: Cu(NO3)2 ve Zn’nin yer değiştirme reaksiyonu ne üretir?
A: Yer değiştirme reaksiyonunda çinko nitrat (Zn(NO3)2) ve bakır metal (Cu) üretilir.
S: Cu(NO3)2 nedir?
C: Cu(NO3)2, mavi kristalli bir bileşik olan bakır nitratın kimyasal formülüdür.
Soru: Aşağıdaki tepkimede aşağıdakilerden hangisi azalır? Cu(NO3)2 + Zn -> Zn(NO3)2 + Cu
C: Reaksiyon sırasında bakır (Cu) indirgenir ve elektron kazanarak metalik bakır oluşur.
S: 0,075 g KOH, 1,0 L Cu(NO3)2 1,0 × 10⁻³ M içinde çözüldüğünde katı bir Cu(OH)2 oluşur mu?
C: Hayır, Cu(NO3)2 çözeltide tamamen iyonlaştığından ve KOH’tan aşırı miktarda OH⁻ iyonu bulunduğundan katı Cu(OH)2 oluşmaz.
