Bakır klorür veya bakır (I) klorür, CuCl kimyasal formülüne sahip, bir bakır atomu ve bir klor atomundan oluşan bir bileşiktir. Kristal yapıya sahip beyaz bir katıdır ve katalizör gibi çeşitli endüstriyel uygulamalarda ve diğer bakır bileşiklerinin üretiminde kullanılır.
| IUPAC Adı | Bakır(I) klorür |
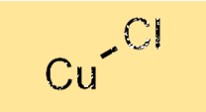
| Moleküler formül | CuCl |
| CAS numarası | 7758-89-6 |
| Eş anlamlı | Bakırlı Monoklorür, Bakır Klorür (CuCl), Bakır(I) Klorür, Bakır Klorür, Nantokit |
| InChI | InChI=1S/ClH.Cu/h1H;/q;+1/p-1 |
Bakır(I) Klorür Formülü
Bakır(I) klorürün formülü CuCl’dir. Bu, her bakır (I) klorür molekülünün bir bakır atomu ve bir klor atomu içerdiğini gösterir. Formül, bir bakır(I) klorür numunesinin kütlesini veya bir numunede mevcut olan bakır(I) klorürün mol sayısını hesaplamak için kullanılabilir. Formül aynı zamanda bileşikte bulunan atomların bağıl sayısı hakkında da bilgi sağlar; bu da bileşiğin özelliklerini ve davranışını anlamak için faydalıdır.
Bakır(I) klorürün molar kütlesi
Bakır(I) klorürün molar kütlesi, bileşiğin bir molünün kütlesidir. Bileşiği oluşturan elementlerin atomik kütlelerinin eklenmesiyle hesaplanır. Bakır(I) klorürün molar kütlesi 98,99 g/mol’dür. Bu değer, bir bakır(I) klorür numunesinin kütlesi ile numunede bulunan mol sayısı arasında dönüşüm yapmak için kullanılabilir.
Bakır(I) klorürün kaynama noktası
Bakır (I) klorürün kaynama noktası, bileşiğin sıvıdan gaza dönüştüğü sıcaklıktır. Bakır(I) klorürün kaynama noktası 1.490°C’dir. Bunun nedeni bakır(I) klorür molekülleri arasındaki zayıf moleküller arası kuvvetlerdir. Bu sıcaklıkta moleküller, onları sıvı halde bir arada tutan çekici kuvvetlerin üstesinden gelmeye yetecek kadar kinetik enerji kazanırlar.
Bakır(I) klorürün erime noktası
Bakır (I) klorürün erime noktası, bileşiğin katıdan sıvıya dönüştüğü sıcaklıktır. Bakır(I) klorürün 430°C gibi nispeten yüksek bir erime noktası vardır. Bunun nedeni, bileşiği oluşturan bakır ve klor atomları arasındaki güçlü iyonik bağlardır. Bu sıcaklıkta bileşiğe sağlanan termal enerji, iyonik bağları kırmaya ve atomların sıvı halde serbestçe hareket etmesine izin vermeye yeterlidir.
Bakır(I) klorürün yoğunluğu g/ml
Bakır (I) klorürün yoğunluğu, birim hacim başına kütlesinin bir ölçüsüdür. Bakır(I) klorürün yoğunluğu oda sıcaklığında 4,14 g/mL’dir. Bu değer, bakır(I) klorürün yoğun bir madde olduğunu ve kendisinden daha az yoğun olan sıvılarda akacağını gösterir.
Bakır(I) Klorürün Moleküler Ağırlığı
Bakır(I) klorürün moleküler ağırlığı, bileşiğin tek bir molekülündeki atomların atom ağırlıklarının toplamıdır. Bakır(I) klorürün moleküler ağırlığı 98,99 g/mol’dür. Bu değer, bakır(I) klorür numunesinin kütlesi ile numunede bulunan moleküllerin sayısı arasında dönüşüm yapmak için kullanılabilir.
Bakır(I) klorürün yapısı
Bakır (I) klorür, bakır atomlarının tetrahedral bir düzende dört klor atomu ile çevrelendiği bir kristal yapıya sahiptir. Bakır atomları, elektronların bakır atomlarından klor atomlarına aktarılmasından kaynaklanan iyonik bağlarla klor atomlarına bağlanır. Bu yapı bakır(I) klorüre yüksek erime noktası ve yoğunluğu gibi karakteristik özelliklerini verir.
| Dış görünüş | Beyaz kristal toz |
| Spesifik yer çekimi | 4,14 g/cm³ |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 98,99 gr/mol |
| Yoğunluk | 4,14 g/cm³ |
| Füzyon noktası | 430°C |
| Kaynama noktası | 1490°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 20°C’de 0,0095 g/L |
| çözünürlük | Konsantre hidroklorik asit, amonyak ve potasyum siyanürde çözünür. Etanol ve eterde çözünmez. |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | 4,6 – 5,8 (%1’lik çözüm) |
Bakır klorürün güvenliği ve tehlikeleri
Bakır klorür çeşitli güvenlik ve sağlık riskleri oluşturur. Yutulması halinde zararlıdır ve gözlerde, ciltte ve solunum sisteminde tahrişe neden olabilir. Bakır klorür ayrıca ateş, titreme ve öksürük gibi gribe benzer semptomlarla karakterize edilen bir durum olan metal dumanı ateşine de neden olabilir. Bakır klorüre uzun süre maruz kalmak akciğer hasarına ve diğer kronik sağlık etkilerine neden olabilir. Bakır klorürle çalışırken, maruz kalma riskini en aza indirmek için koruyucu kıyafet, eldiven ve göz koruması kullanmak önemlidir. Yutulması veya kazara maruz kalması durumunda derhal tıbbi yardıma başvurun. Çevre kirliliğini ve insan sağlığına zarar vermesini önlemek için bakır klorürün uygun şekilde işlenmesi, depolanması ve imha edilmesi gereklidir.
| Tehlike sembolleri | Kurukafa ve kırık kemikler |
| Güvenlik Açıklaması | Yemeyin. Koruyucu kıyafet, eldiven ve göz koruması kullanın. Yutulması veya maruz kalması durumunda derhal tıbbi yardıma başvurun. Uygun taşıma, depolama ve imha gereklidir. |
| BM kimlik numaraları | BM 3077 |
| HS kodu | 28273910 |
| Tehlike sınıfı | 6.1 |
| Paketleme grubu | II |
| Toksisite | Yutulması veya solunması halinde toksiktir. Cilt ve göz tahrişine neden olur. Akciğer hasarına ve diğer kronik sağlık etkilerine neden olabilir. |
Bakır klorürün sentezi için yöntemler
Bakır klorürü sentezlemek için birkaç yöntem vardır:
Yaygın bir yöntem, bakır ve hidroklorik asit arasındaki reaksiyonu içerir. Metalik bakır hidroklorik asitle reaksiyona girerek CuCl ve hidrojen gazı üretir. CuCl, filtreleme ve kurutma yoluyla saflaştırılabilir.
Başka bir yöntem, bakır oksit ile hidroklorik asit arasındaki reaksiyonu içerir.
Bakır klorürü sentezlemek için, CuCl2 üretmek üzere hidroklorik asit çözeltisine bakır oksit eklenebilir. Bundan sonra, CuCl2’yi CuCl oluşturacak şekilde indirgemek için hidroklorik asit veya kükürt dioksit gibi bir indirgeyici madde kullanılabilir.
CuCl2’yi sentezlemenin başka bir yöntemi, bakır sülfat ve sodyum klorürün suda çözülmesini, elde edilen çözeltinin ısıtılmasını ve safsızlıkların giderilmesi için filtrelenmesini içerir. Elde edilen çözeltinin filtrelenmesinden sonra CuCl kristalleri oluşturacak şekilde soğutulması mümkündür.
Bu yöntemin bir varyasyonu, askorbik asit veya glukoz gibi indirgeyici ajanların varlığında bakır sülfat ve sodyum klorür arasındaki reaksiyonu içerir. İndirgeyici madde, bakır sülfattaki Cu2+ iyonlarını Cu+ iyonlarına indirger ve bunlar daha sonra sodyum klorürdeki klorür iyonlarıyla reaksiyona girerek CuCl oluşturur.
Genel olarak bu yöntemler, kullanılan hammaddelere ve koşullara bağlı olarak bakır klorürün sentezlenmesi için bir dizi seçenek sunar. Bakır klorürün sentezlenmesi ve işlenmesi sırasında güvenlik ve çevresel hususlara dikkat edilmesi gerekmektedir.
Bakır klorürün kullanım alanları
Bakır klorürün çeşitli alanlarda çeşitli uygulamaları vardır. İşte bakır klorürün bazı yaygın kullanımları:
- Kataliz: Farmasötikler ve tarım kimyasalları gibi organik bileşiklerin sentezi de dahil olmak üzere çeşitli kimyasal reaksiyonlarda katalizör olarak kullanılır.
- Pigment: Seramik ve cam sanayinde pigment olarak kullanılır. Ürünlere yeşil renk verir.
- Zehirli Madde: Denizcilik uygulamalarında, gemilerde ve teknelerde midye, alg ve diğer deniz organizmalarının büyümesini önlemek için zehirli boya maddesi olarak kullanılır.
- Fotoğrafçılık: Siyah beyaz görüntüler üretmek için fotoğraf geliştiricisi olarak kullanılır. Gümüş iyonlarını metalik gümüşe dönüştürmek için indirgeyici madde olarak kullanılır.
- Elektrokaplama: Bir alt tabaka üzerine bir bakır tabakası yerleştirmek için elektrokaplamada kullanılır. Elektronik bileşenlerin, mücevherlerin ve diğer ürünlerin imalatında kullanılır.
- Mantar ilacı: Bitkileri mantar hastalıklarından korumak için mantar ilacı olarak kullanılır.
- Lehimleme: Kaynak işleminde kaynak öncesi metal yüzeylerdeki oksit tabakalarının uzaklaştırılması için kullanılır.
- Aşındırma: Baskılı devre kartları ve diğer elektronik bileşenlerin üretiminde aşındırma maddesi olarak kullanılır.
Bakır klorür, ayırt edici özelliklerinden dolayı çeşitli endüstrilerde yaygın olarak kullanılmaktadır. Endüstriler bunu katalizden deniz kaplamalarına kadar çeşitli uygulamalarda kullanır.
Sorular:
S: CuCl suda çözünür mü?
C: Evet, CuCl suda az çözünür, çözünürlüğü oda sıcaklığında yaklaşık 0,67 g/L’dir.
S: CuCl çözünür mü?
C: CuCl suda az çözünür, ancak etanol ve eter gibi organik çözücülerde çözünmez.
S: CuCl’nin adı nedir?
C: CuCl’nin adı bakır klorürdür.
S: Alüminyum bir CuCl çözeltisine yerleştirildiğinde kabarcıklara neden olan şey nedir? C: Alüminyum bir CuCl çözeltisine yerleştirildiğinde, alüminyumun CuCl’deki Cu2+ iyonlarını Cu+ iyonlarına indirgediği ve alüminyum klorür (AlCl3) ve metalik bakır (Cu) oluşturduğu bir redoks reaksiyonu meydana gelir. Gözlenen kabarcıklar, çözeltide bulunan alüminyum ve su molekülleri arasındaki reaksiyonun bir yan ürünü olarak üretilen hidrojen gazıdır (H2).
