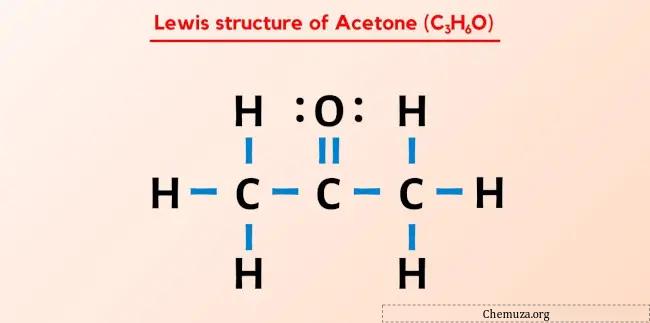
Asetonun Lewis yapısı (aynı zamanda propanon veya C3H6O olarak da bilinir), merkezi karbon (C) atomuna çift bağlı bir oksijen (O) atomuna ve bağlı üç tek hidrojen (H) atomuna sahip olan üç ardışık karbon (C) atomuna sahiptir. her bir dış karbon (C) atomuna. Oksijen (O) atomunda 2 ortaklanmamış çift vardır.
Asetonun Lewis yapısını basit adımlarla anlayalım.
Asetonun Lewis Yapısını Çizme Adımları (C3H6O)
Adım 1: C3H6O molekülündeki toplam değerlik elektronu sayısını bulun
Bir C3H6O molekülündeki toplam değerlik elektron sayısını bulmak için öncelikle karbon atomunda , hidrojen atomunda ve oksijen atomunda bulunan değerlik elektronlarını bilmeniz gerekir.
(Değerlik elektronları herhangi bir atomun en dış yörüngesinde bulunan elektronlardır.)
Burada size periyodik tabloyu kullanarak karbon, hidrojen ve oksijenin değerlik elektronlarını nasıl kolayca bulacağınızı anlatacağım.
C3H6O molekülündeki toplam değerlik elektronları
→ Karbon atomunun verdiği değerlik elektronları:
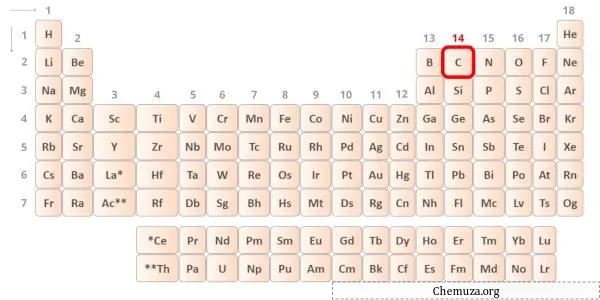
Karbon periyodik tablonun 14. grubunda yer alan bir elementtir. [1] Bu nedenle karbonda bulunan değerlik elektronları 4’tür .
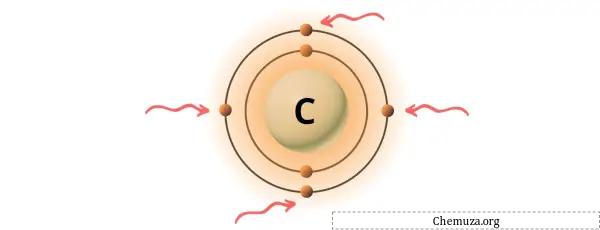
Yukarıdaki resimde gösterildiği gibi karbon atomunda bulunan 4 değerlik elektronunu görebilirsiniz.
→ Hidrojen atomunun verdiği değerlik elektronları:
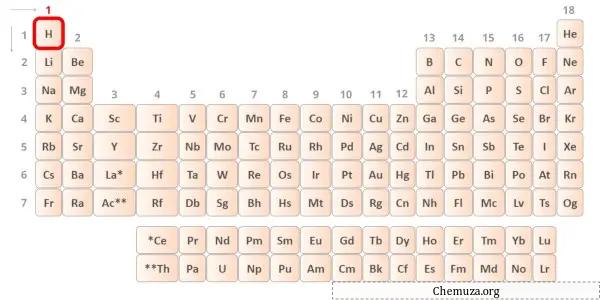
Hidrojen periyodik tablonun 1. grup elementidir.[2] Bu nedenle hidrojende bulunan değerlik elektronu 1’dir .

Yukarıdaki resimde gösterildiği gibi hidrojen atomunda yalnızca bir değerlik elektronunun bulunduğunu görebilirsiniz.
→ Oksijen atomunun verdiği değerlik elektronları:

Oksijen periyodik tablonun 16. grubunda yer alan bir elementtir. [3] Bu nedenle oksijende bulunan değerlik elektronları 6’dır .
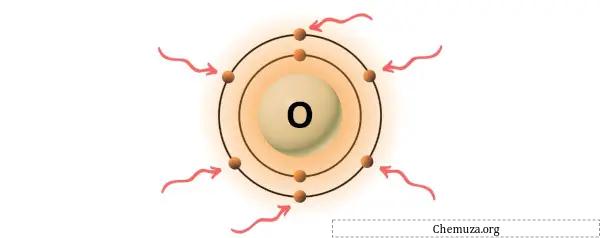
Yukarıdaki resimde gösterildiği gibi oksijen atomunda bulunan 6 değerlik elektronunu görebilirsiniz.
Bu yüzden,
C3H6O molekülündeki toplam değerlik elektronları = 3 karbon atomu tarafından bağışlanan değerlik elektronları + 6 hidrojen atomu tarafından bağışlanan değerlik elektronları + 1 oksijen atomu tarafından bağışlanan değerlik elektronları = 4(3) + 1(6) + 6 = 24 .
Adım 2: Taslağı hazırlayın
Asetonun Lewis yapısı, merkezi karbon atomuna bağlı bir oksijen atomu ile ardışık üç karbon atomuna sahiptir. Hidrojen atomları iki dış karbon atomuna bağlanır. Oksijen atomu karbon atomuna çift bağlıyken, hidrojen atomları karbon atomuna tek bağlıdır.
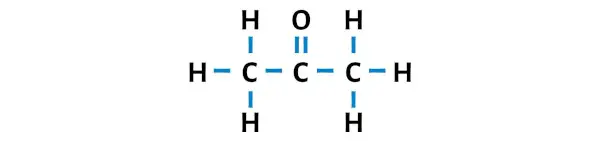
Adım 3: Dış atomları kararlı hale getirin
Burada C3H6O molekülünün çiziminde dıştaki atomların hidrojen atomları ve oksijen atomları olduğunu görebilirsiniz.
Hidrojen atomları kararlıdır çünkü 2 elektrona sahiptirler (çünkü hidrojenin kararlı bir çift oluşturmak için yalnızca 2 elektrona ihtiyacı vardır).
Şimdi oksijen atomunu üzerinde bir oktet oluşturarak kararlı hale getirelim.
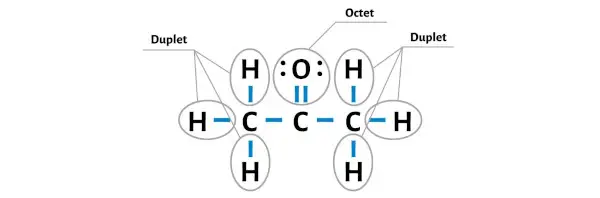
Artık tüm dış atomların kararlı olduğunu görebilirsiniz.
Ek olarak 1. adımda C3H6O molekülünde bulunan toplam değerlik elektron sayısını hesapladık.
C3H6O molekülünün toplam 24 değerlik elektronu vardır ve bu değerlik elektronlarının tümü yukarıdaki C3H6O diyagramında kullanılmıştır.
Bu nedenle C3H6O’nun (veya asetonun) yukarıdaki Lewis yapısı kararlı bir yapıdır.
Umarım yukarıdaki adımları anladınız.
Daha fazla pratik yapmak ve daha iyi anlamak için aşağıda listelenen diğer Lewis yapılarını deneyebilirsiniz.
Daha iyi anlamak için şu Lewis yapılarını deneyin (veya en azından görün):
