Asetofenon veya metilfenil keton, C8H8O formülüne sahip aromatik bir organik bileşiktir. Parfüm ve reçine üretiminde, farmasötiklerde solvent ve ara madde olarak kullanılır.
| IUPAC Adı | 1-feniletanon |
| Moleküler formül | C8H8O |
| CAS numarası | 98-86-2 |
| Eş anlamlı | Metilfenilketon, fenilmetilketon, AP, asetilbenzen, benzoilmetil, etilfenilketon, Hypnon |
| InChI | InChI=1S/C8H8O/c1-7(9)8-5-3-2-4-6-8/h2-6H,1H3 |
Asetofenonun yapısı
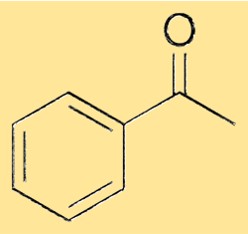
Asetofenonun yapısı, bir karbonil grubuna tek bir bağ yoluyla bağlanan bir fenil grubundan oluşur. Karbonil grubu, bir oksijen atomuna çift bağlı bir karbon atomundan oluşur. Fenil grubu, beş hidrojen atomunun bağlı olduğu altı üyeli bir karbon atomu halkasıdır ve altıncı pozisyon, karbonil karbon atomu tarafından işgal edilir. Bu yapı, asetofenona karakteristik özelliklerini verir ve çeşitli kimyasalların sentezi için çok yönlü bir hammadde olarak hizmet etmesine olanak tanır.
Asetofenon Erime Noktası
Asetofenonun erime noktası -15,7°C’dir. Erime noktası, katının sabit basınçta sıvıya dönüştüğü sıcaklıktır. Asetofenon, oda sıcaklığında kristalimsi bir katıdır ve diğer benzer bileşiklerle karşılaştırıldığında nispeten düşük bir erime noktasına sahiptir. Bir bileşiğin erime noktası, onun moleküler yapısı ve moleküller arası kuvvetlerin kuvveti ile belirlenir.
Asetofenonun IR spektrumu
Asetofenonun IR spektrumu, karbonil grubuna karşılık gelen 1705 cm^-1’de ve aromatik CH’nin gerilmesine karşılık gelen 3030-3100 cm^-1’de karakteristik zirveler gösterir. Bu zirveler, molekülde bulunan fonksiyonel gruplara ilişkin önemli bilgiler sağlar.
Asetofenonun molar kütlesi:
Asetofenonun molar kütlesi 120,15 g/mol’dür. Bir fenil halkasına bağlı bir karbonil grubuna sahip aromatik bir organik bileşiktir. Molar kütle, bileşiğin bir molünde bulunan atomların atomik kütlelerinin toplamıdır. Asetofenon durumunda, 8 karbon atomu, 8 hidrojen atomu ve bir oksijen atomu vardır ve bir molekülde toplam 17 atom bulunur. Molar kütle bir bileşiğin önemli bir özelliğidir çünkü kimya ve endüstrideki çeşitli uygulamalar için gerekli olan belirli bir numunedeki madde miktarını hesaplamak için kullanılır.
Asetofenonun kaynama noktası
Asetofenonun kaynama noktası 202°C’dir. Kaynama noktası, bir sıvının sabit basınçta gaza dönüştüğü sıcaklıktır. Asetofenon uçucu bir organik bileşiktir ve diğer benzer bileşiklerle karşılaştırıldığında nispeten yüksek bir kaynama noktasına sahiptir. Bir bileşiğin kaynama noktası, molekülleri sıvı veya katı halde bir arada tutan kuvvetler olan moleküller arası kuvvetlerin kuvveti ile belirlenir. Asetofenon durumunda, diğer asetofenon molekülleriyle hidrojen bağları oluşturabilen, moleküller arası kuvvetleri güçlendiren ve kaynama noktasını artıran bir polar karbonil grubuna sahiptir.
Metilfenil ketonun yoğunluğu g/ml
Metilfenil ketonun oda sıcaklığında 1,03 g/mL yoğunluğu vardır. Yoğunluk, bir maddenin birim hacim başına kütlesidir. Metilfenil keton, oda sıcaklığında bir sıvıdır ve diğer benzer bileşiklerle karşılaştırıldığında nispeten yüksek bir yoğunluğa sahiptir. Bir bileşiğin yoğunluğu, molekül ağırlığı ve moleküllerinin belirli bir hacimdeki yoğunluğu ile belirlenir. Metilfenil keton durumunda, nispeten yüksek bir moleküler ağırlığa ve nispeten kompakt bir moleküler yapıya sahiptir, bu da moleküllerinin paketlenmesini daha verimli hale getirir ve yoğunluğu arttırır.
Metilfenil ketonun moleküler ağırlığı
Metilfenil ketonun moleküler ağırlığı 120,15 g/mol’dür. Molekül ağırlığı, bir moleküldeki tüm atomların atom ağırlıklarının toplamıdır. Metilfenil ketonun 8 karbon atomu, 8 hidrojen atomu ve bir oksijen atomu vardır ve bir molekülde toplam 17 atom bulunur. Molekül ağırlığı bir bileşiğin önemli bir özelliğidir çünkü belirli bir numunedeki kimya ve endüstrideki çeşitli uygulamalar için gerekli olan madde miktarını hesaplamak için kullanılır.
| Dış görünüş | Renksiz ila soluk sarı sıvı |
| Spesifik yer çekimi | 25°C’de 1,028-1,031 |
| Renk | Renksizden soluk sarıya |
| Koku | Tatlı, çiçeksi, ballı |
| Molar kütle | 120,15 gr/mol |
| Yoğunluk | 25°C’de 1,03 g/mL |
| Füzyon noktası | -15,7°C |
| Kaynama noktası | 202°C |
| Flaş noktası | 78°C |
| sudaki çözünürlük | 25°C’de 3,3 g/L |
| çözünürlük | Alkol, eter, kloroform ve benzende çözünür |
| Buhar basıncı | 25°C’de 0,27 mmHg |
| Buhar yoğunluğu | 4,15 (hava = 1) |
| pKa | 10.01 |
| pH | Uygulanamaz (metilfenil keton ne asit ne de bazdır) |
Metilfenil ketonun güvenliği ve tehlikeleri
Metilfenil keton doğru şekilde kullanılmazsa tehlikeli olabilir. Temas veya solunması halinde ciltte, gözlerde ve solunum sisteminde tahrişe neden olabilir. Yüksek konsantrasyonlarda metilfenil keton buharına doğrudan maruz kalmak baş ağrısına, baş dönmesine veya mide bulantısına neden olabilir. Metilfenil ketonun yutulması mide-bağırsak tahrişine, kusmaya veya ishale neden olabilir. Metilfenil keton da yanıcıdır ve havayla patlayıcı karışımlar oluşturabilir. Ateş kaynaklarından uzakta, serin, kuru ve iyi havalandırılan bir yerde saklanmalıdır. Metilfenil ketonla çalışırken eldiven, koruyucu gözlük ve solunum cihazı gibi kişisel koruyucu ekipmanlar giyilmelidir.
| Tehlike sembolleri | Xi: Tahriş edici, F: Yüksek derecede yanıcı |
| Güvenlik Açıklaması | S16: Tutuşturucu kaynaklardan uzak tutun – Sigara içmeyin, S26: Gözle teması halinde bol su ile yıkayın ve doktora başvurun, S36: Uygun koruyucu kıyafet giyin, S37: Uygun eldiven kullanın, S39: Uygun kıyafet giyin koruyucu giysi. yüz koruması |
| BM kimlik numaraları | BM 2319 |
| HS kodu | 291439 |
| Tehlike sınıfı | 3 (Yanıcı sıvılar) |
| Paketleme grubu | III |
| Toksisite | Metilfenil keton, Kategori 3 gözleri tahriş edici ve Kategori 4 cildi tahriş edici olarak sınıflandırılır. Kanserojen veya mutajen olarak kabul edilmez. Sıçanlarda oral LD50 (test edilen deneklerin %50’si için öldürücü doz) yaklaşık 3.000 mg/kg’dır. Önemli bir çevresel risk olarak görülmemektedir. |
Metilfenil ketonun sentezi için yöntemler
Metilfenil ketonu sentezlemek için çeşitli yöntemler mevcuttur.
Yaygın bir yöntem, benzenin, alüminyum klorür gibi bir Lewis asidi katalizörünün varlığında asetil klorürle Friedel-Crafts asilasyonudur. Bu reaksiyon, yan ürünler olarak metilfenil keton ve hidrojen klorür üretir.
Diğer bir yöntem ise etilbenzenin kobalt veya manganez gibi bir metal katalizör varlığında hava veya oksijen kullanılarak oksidasyonudur. Bu reaksiyon, yan ürünler olarak metilfenil keton ve asetik asit üretir.
Metilfenilketon, sodyum borohidrit veya lityum alüminyum hidrit gibi indirgeyici maddeler kullanılarak fenilasetonun indirgenmesiyle sentezlenebilir. Bu reaksiyon, yan ürünler olarak metilfenil ketonu ve karşılık gelen alkolü üretir.
Başka bir yöntem, yan ürünler olarak metilfenil keton ve hidrojen klorürün üretilmesi için bir alüminyum klorür katalizörü varlığında benzoil klorürün etilbenzen ile reaksiyonunu içerir.
Metilfenil ketonun kullanımları
Metilfenil ketonun çeşitli endüstrilerde çeşitli kullanımları vardır.
- Metilfenil keton, çeşitli reçineler, selüloz esterler ve plastikler için çözücü olarak yaygın şekilde kullanılır.
- Gıda endüstrisi, özellikle kiraz ve badem aromaları için aroma maddesi olarak metilfenil ketonu kullanır.
- Parfüm endüstrisi, parfüm ve diğer kokulu ürünlerin üretiminde hammadde olarak metilfenil ketonu kullanır.
- Farmasötikler, tarım kimyasalları ve boyalar gibi çeşitli kimyasallar, metilfenil keton kullanılarak sentezlenir.
- Metilfenilketon, amfetamin sentezinin öncüsü olan fenilaseton üretiminde bir ara madde olarak görev yapar.
- Sabun ve deterjanlarda kullanılan bir koku olan kumarin, metilfenil ketondan sentezlenir.
- Organik kimya reaktifleri, çeşitli bileşiklerin sentezi için reaktif olarak metilfenil ketonu kullanır.
- Metilfenilketon, stiren ve metilstiren gibi diğer kimyasalların üretiminde hammadde görevi görür.
Genel olarak metil fenil keton, çok yönlü özellikleri ve kullanımları nedeniyle çeşitli endüstrilerde geniş bir uygulama alanına sahiptir.
Sorular:
S: Asetofenon polar mıdır?
C: Evet, asetofenon, bir karbonil grubunun (C=O) ve bir dipol momenti oluşturan bir fenil halkasının varlığından dolayı polardır.
S: Benzaldehit mi yoksa asetofenon mu daha polardır?
C: Benzaldehit, asetofenondan daha polardır çünkü fenil halkasına ek olarak bir aldehit grubunun (CHO) varlığı nedeniyle daha yüksek bir dipol momentine sahiptir.
S: Asetofenonun IR spektrumu?
C: Asetofenonun IR spektrumu, karbonilin (C=O) gerilme titreşiminin karakteristiği olan, 1700 cm^-1 civarında güçlü ve geniş bir absorpsiyon bandı gösterir. Ayrıca aromatik CH’nin gerilme titreşimlerine karşılık gelen 3000-3100 cm^-1 civarında zirveler gösterir.
S: Asetofenondan benzoik asite mi?
C: Asetofenon, potasyum permanganat veya kromik asit gibi bir oksitleyici madde kullanılarak oksidasyon yoluyla benzoik aside dönüştürülebilir. Bu reaksiyon, karbonil grubuna bitişik karbon-karbon bağının bölünmesiyle sonuçlanır, ardından elde edilen ara ürünün oksidasyonu ile benzoik asit üretilir.
S: Benzenden asetofenona mı?
C: Benzen, alüminyum klorür gibi bir Lewis asidi katalizörünün varlığında asetil klorür veya asetik anhidrit kullanılarak Friedel-Crafts asilasyonu yoluyla asetofenona dönüştürülebilir. Bu reaksiyon, benzenin bir hidrojen atomunun bir asetil grubu (-COCH3) ile ikame edilmesi ve ardından asetofenon oluşturacak şekilde yeniden düzenlenmesi ile sonuçlanır.
