Amonyum nitrat (NH4NO3) kimyasal bir bileşiktir. Gübre veya patlayıcı olarak kullanılabilir. Suda oldukça çözünür ve higroskopiktir.
| IUPAC’ın adı | Amonyum nitrat |
| Moleküler formül | NH4NO3 |
| CAS numarası | 6484-52-2 |
| Eş anlamlı | Nitrik asidin amonyum tuzu, Amonyum nitrat (AN), Amonyum nitrat, Nitram, Nitramon |
| InChI | InChI=1S/NO3.H3N/c2-1(3)4;/h;1H3/q-1;/p+1 |
Amonyum nitratın özellikleri
Amonyum Nitrat Formülü
Amonyum nitrat, NH4NO3 formülüne sahip kimyasal bir bileşiktir. İyonik bir bağla bir arada tutulan iki iyondan oluşur: amonyum (NH4+) ve nitrat (NO3-). Suda kolayca çözünen beyaz kristal bir tozdur.
Amonyum Nitrat Molar Kütlesi
NH4NO3’ün molar kütlesi 80.043 g/mol’dür. Bileşen elementlerinin molar kütleleri eklenerek hesaplanabilir: nitrojen, hidrojen ve oksijen. Azotun molar kütlesi 14.0067 g/mol, hidrojenin molar kütlesi 1.00784 g/mol ve oksijenin molar kütlesi 15.9999 g/mol’dür.
NH4NO3’ün molar kütlesi = 2 x nitrojenin molar kütlesi + 4 x hidrojenin molar kütlesi + 3 x oksijenin molar kütlesi
NH4NO3’ün molar kütlesi = 28,0134 g/mol + 4,03136 g/mol + 47,9997 g/mol
NH4NO3’ün molar kütlesi = 80,043 g/mol
Amonyum nitratın kaynama noktası
NH4NO3’ün tanımlanmış bir kaynama noktası yoktur. Yüksek sıcaklıklarda ayrışır ve nitrojen, oksijen ve su buharı gibi gazlar açığa çıkarır. NH4NO3’ün ayrışma sıcaklığı saflığa, neme ve yabancı maddelerin veya katkı maddelerinin varlığına bağlı olarak değişir. Saf NH4NO3’ün ayrışma sıcaklığı yaklaşık 210°C veya 483 K’dir.
Amonyum nitratın erime noktası
NH4NO3’ün erime noktası 169,6 °C veya 442,8 K’dir. Bu sıcaklıkta eşkenar dörtgen kristal yapıdan kübik kristal yapıya faz geçişine uğrar. Aynı zamanda -16 °C veya 257 K civarında daha düşük bir erime noktasına sahip olan su ile ötektik bir karışım da oluşturabilir.
Amonyum nitratın yoğunluğu g/ml
NH4NO3’ün yoğunluğu ortam sıcaklığı ve basıncında 1,725 g/ml veya 1725 kg/m3’tür. Aynı koşullar altında yoğunluğu yaklaşık 1 g/ml veya 1000 kg/m3 olan sudan daha yoğundur. Sıcaklık arttıkça termal genleşmeden dolayı NH4NO3’ün yoğunluğu azalır.
Amonyum Nitrat Molekül Ağırlığı
NH4NO3’ün moleküler ağırlığı, 80.043 g/mol olan molar kütlesiyle aynıdır. Molekül ağırlığı, bir molün veya 6,022 x 10^(23) NH4NO3 molekülünün kütlesidir. Molekül ağırlığı aynı zamanda bir karbon-12 atomunun kütlesinin on ikide biri olarak tanımlanan atomik kütle birimleri (amu) cinsinden de ifade edilebilir.
NH4NO3’ün amu cinsinden molekül ağırlığı 80,043 x (1/12) x (10^(23)) amu’dur.
NH4NO3’ün amu cinsinden molekül ağırlığı yaklaşık 6,669 x 10^(23) amu’dur.
Amonyum nitratın yapısı
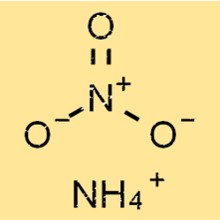
NH4NO3, pozitif yüklü amonyum iyonları ve negatif yüklü nitrat iyonlarından oluşan basit bir iyonik yapıya sahiptir. Amonyum iyonu, dört hidrojen atomunun merkezi bir nitrojen atomuna kovalent bağlarla bağlı olduğu tetrahedral bir şekle sahiptir.
NH4+
H
|
HNH
|
H
Nitrat iyonu, biri çift bağ olan kovalent bağlarla merkezi bir nitrojen atomuna bağlanan üç oksijen atomundan oluşan, üçgen düzlemsel bir şekle sahiptir.
Numara 3-
Ah
||
Ah
Amonyum nitratın çözünürlüğü
NH4NO3’ün çözünürlüğü, bu bileşiğin su veya diğer çözücüler içinde çözünen miktarını ifade eder. NH4NO3 suda çok çözünür ve çözünürlüğü sıcaklıkla artar. Örneğin 20°C’de 100 ml suda 150 g NH4NO3 çözünebilirken, 100°C’de aynı miktarda suda 1024 g NH4NO3 çözünebilir. NH4NO3 ayrıca metanol, etanol ve asetonda da çözünür, ancak dietil eter veya kloroformda çözünmez. NH4NO3’ün çözünürlüğü asitler, bazlar, tuzlar veya organik bileşikler gibi diğer maddelerin varlığına bağlıdır. Bu maddelerin bazıları NH4NO3’ün stabilitesini etkileyebilir ve ayrışmasına veya patlamasına neden olabilir.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yoğunluk | 1.725 |
| Renk | Beyaz veya gri |
| Koku | Kokusuz |
| Molar kütle | 80.043 gr/mol |
| Yoğunluk | 1,725 g/ml veya 1725 kg/m3 |
| Füzyon noktası | 169,6°C veya 442,8K |
| Kaynama noktası | Yaklaşık olarak. 210°C veya 483 K (ayrışır) |
| Flaş noktası | Yanıcı değil |
| sudaki çözünürlük | Endotermik, 118g/100ml (0°C), 150g/100ml (20°C), 297g/100ml (40°C), 410g/100ml (60°C), 576g/100ml (80°C), 1024g/100ml (100°C) |
| çözünürlük | Suda, metanolde, etanolde, asetonda çözünür; dietil eter, kloroformda çözünmez |
| Buhar basıncı | Oda sıcaklığında ihmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz (katı) |
| pKa | 9,25 (NH4+ için) |
| pH | 5,0-6,0 (%10 sulu çözelti) |
Amonyum nitratın güvenliği ve tehlikeleri
NH4NO3’ün güvenliği ve tehlikeleri, bu kimyasal bileşiği kullanan veya saklayan herkesin bilmesi önemlidir. NH4NO3, yanıcı maddelerle karıştırıldığında veya ısıya, şoka veya kirlenmeye maruz kaldığında yangını yoğunlaştırabilen ve patlamalara neden olabilen bir oksitleyicidir. NH4NO3 ayrıca parçalandığında nitrojen oksitler ve amonyak gibi zehirli gazlar da açığa çıkarabilir. Bu nedenle insanlar NH4NO3’ü kullanırken şu güvenlik önlemlerine uymalıdır:
- Serin, kuru ve iyi havalandırılan bir yerde, ateş kaynaklarından, organik maddelerden, asitlerden, metallerden ve diğer uyumsuz malzemelerden uzakta saklayın.
- Kullanım sırasında koruyucu kıyafet, eldiven, göz ve yüz koruması kullanın.
- Taşıma sırasında toz oluşmasından kaçının ve yeterli havalandırma kullanın.
- Elleçlemeden sonra ellerinizi ve yüzünüzü iyice yıkayın.
- Yutmayın veya solumayın ve maruz kalma durumunda doktora başvurun.
- Yerel acil durum müdahale ekiplerini tesisteki NH4NO3 varlığı konusunda bilgilendirin ve bir acil durum müdahale planı hazırlayın.
| Tehlike sembolleri | O (oksitleyici madde), Xi (tahriş edici) |
| Güvenlik Açıklaması | S17 (yanıcı maddelerden uzak tutun), S26 (gözlerle teması halinde derhal bol su ile yıkayın ve tıbbi yardım alın), S36/37/39 (uygun koruyucu kıyafet, eldiven ve göz/yüz koruyucu kullanın), S42 (fümigasyon/püskürtme sırasında uygun solunum ekipmanı kullanın) |
| BM kimlik numaraları | S17 (yanıcı maddelerden uzak tutun), S26 (gözlerle teması halinde derhal bol su ile yıkayın ve tıbbi yardım alın), S36/37/39 (uygun koruyucu kıyafet, eldiven ve göz/yüz koruyucu kullanın), S42 (fümigasyon/püskürtme sırasında uygun solunum ekipmanı kullanın) |
| HS kodu | 3102.30 (amonyum nitrat, sulu çözelti içinde olsun olmasın) |
| Tehlike sınıfı | 5.1 (oksitleyici madde) |
| Paketleme grubu | III (düşük tehlike) |
| Toksisite | LD50 (oral, sıçan) = 2,085-5,300 mg/kg |
Amonyum nitrat sentez yöntemleri
Yaygın olarak gübre ve patlayıcı olarak kullanılan bu kimyasal bileşiği üretmek için kimyagerler NH4NO3’ü sentezlemek için çeşitli yöntemler kullanırlar. NH4NO3’ü sentezlemek için farklı yöntemler vardır, ancak en yaygın olanları şunlardır:
- Haber-Bosch ve Ostwald süreci: Bu yöntem, nitrojen ve hidrojen gazlarının amonyak oluşturmak üzere reaksiyona sokulmasını, ardından amonyağın hava ile oksitlenerek nitrik asit oluşturulmasını içerir. NH4NO3 oluşturmak için amonyak ve nitrik asidi nötralize ederler. Bu yöntem yüksek sıcaklık, basınç ve enerji gerektirir ve çok fazla karbondioksit yayar.
- Metatez reaksiyonu: Bu yöntem, çözünür bir amonyum tuzunun, çözünür bir nitrat tuzu ile reaksiyona sokularak NH4NO3 ve başka bir tuzun oluşturulmasını içerir. Örneğin amonyum sülfat ve baryum nitrat, NH4NO3 ve baryum sülfat oluşturacak şekilde reaksiyona girebilir. Bu yöntem basittir ve yüksek sıcaklık veya basınç gerektirmez, ancak ayrılması veya imha edilmesi gerekebilecek bir yan ürün üretir.
- Plazma işlemi: Bu yöntem, topraktaki havadaki nitrojeni sabitlemek için düşük sıcaklıkta ve düşük basınçta bir plazmanın kullanılmasını ve böylece doğrudan toprakta NH4NO3 oluşturulmasını içerir. Bu yöntem hidrojen gazı veya katalizör gerektirmez ve karbondioksit yaymaz. Ayrıca toprağı nitrojenle zenginleştirebilir ve bitki gelişimini iyileştirebilir.
Amonyum nitratın kullanım alanları
NH4NO3’ün bazı kullanımları şunlardır:
- Gübre: NH4NO3, tamamı bitkiler tarafından alınabilen yaklaşık %33,5 oranında nitrojen içerdiğinden bitkiler için yaygın bir nitrojen kaynağıdır. Üreticiler beyaz veya gri amonyum karbonat peletlerini topaklanmasını ve nemi emmesini önlemek için kil ile kaplıyorlar. Suda kolayca çözündüğü için katı veya çözelti halinde uygulayabilirler.
- Patlayıcı: NH4NO3 nitrogliserin, TNT, RDX veya alüminyum tozu gibi diğer patlayıcıların patlamasını artırabilen oksitleyici bir maddedir. Kuzey Amerika’da kullanılan patlayıcıların %80’ini oluşturan, yaygın olarak kullanılan endüstriyel patlayıcı, ana maddesi olarak ANFO (NH4NO3 ve akaryakıt) içermektedir. El yapımı patlayıcı cihazlarda kullanıldığında onu patlatmak için güçlü bir tetikleyici gerekir, ancak endüstriyel uygulamalar da onu kullanabilir.
- Piroteknik: Havai fişekler, duman, kıvılcımlar, yıldızlar ve şimşek gibi çeşitli efektler yaratmak için NH4NO3’ü kullanabilir. Suyla karıştırıldığında endotermik reaksiyon oluşturan soğuk kompresler de kullanılabilir.
- Diğer kullanımlar: Azot oksidin (gülme gazı) öncüsü, anestezik ve itici gaz olarak kullanılır. Azot oksitler emici olarak kullanılabilir, maya ve antibiyotikler besin maddesi olarak kullanılabilir ve dondurucu karışımları bileşen olarak kullanılabilir.
Sorular:
Soru: Amonyum nitrat gübresi nereden geliyor?
C: NH4NO3 gübresi, amonyak ve nitrik asidin reaksiyonundan kaynaklanan sentetik bir üründür. Amonyak, doğal gazdan veya diğer kaynaklardan elde edilir ve nitrik asit, amonyağın hava ile oksitlenmesiyle üretilir. NH4NO3 gübresi, havadaki nitrojeni toprağa sabitleyen bir plazma işlemi kullanılarak da üretilebilir.
Soru: Amonyum nitrat nedir?
C: NH4NO3, NH4NO3 formülüne sahip kimyasal bir bileşiktir. Amonyum ve nitrat iyonlarından oluşan beyaz kristalli bir tuzdur. Suda yüksek oranda çözünür ve katı formda higroskopiktir, ancak hidrat oluşturmaz.
Soru: Amonyum nitrat ne için kullanılır?
C: NH4NO3 esas olarak iki amaç için kullanılır: gübre olarak ve patlayıcı olarak. Bir gübre olarak bitkilere büyümeleri ve metabolizmaları için gerekli olan nitrojeni sağlar. Bir patlayıcı olarak, ANFO (NH4NO3 ve akaryakıt) 1 gibi diğer patlayıcıların patlamasını teşvik eden bir oksidan görevi görür. Ayrıca nitröz oksit (gülme gazı), soğuk kompres, havai fişek ve maya besinleri yapmak gibi başka amaçlar için de kullanılabilir.
S: Amonyum nitratın moleküler formülü nedir?
C: Amonyum nitratın moleküler formülü NH4NO3’tür. Molar kütlesi 80.043 g/mol’dür ve kütlece %35 nitrojen içerir.
Soru: Amonyum nitrat gübresi neyden yapılır?
C: NH4NO3 gübresi, NH4NO3’ten ve bazen kil, topaklanma önleyici maddeler veya stabilizatörler gibi diğer katkılardan oluşur. Ticari sınıf yaklaşık %33,5 oranında nitrojen içerir ve tamamı bitki tarafından alınabilecek formlardadır.
Soru: Amonyum nitrat asit mi yoksa baz mı?
C: NH4NO3 ne asit ne de bazdır, tuzdur. Suda, çözeltinin pH’ına bağlı olarak zayıf asit veya baz görevi görebilen amonyum ve nitrat iyonlarına ayrışabilir. Amonyum iyonunun pKa’sı 9,25’tir; bu, bir proton bağışlayabileceği ve bazik çözeltilerde asit görevi görebileceği anlamına gelir. Nitrat iyonunun pKa’sı yoktur, yani proton bağışlayamaz veya kabul edemez, ancak asidik çözeltilerde hidronyum iyonlarıyla nitrik asit oluşturarak baz görevi görebilir.
Soru: Amonyum nitrat patlaması mı?
C: NH4NO3 patlaması, NH4NO3’ün hızla ayrışıp nitrojen, oksijen ve su buharı gibi büyük miktarda gaz açığa çıkarmasıyla meydana gelen şiddetli bir kimyasal reaksiyondur. Ayrışma ısı, şok, sürtünme, kirlenme veya hapsedilme ile tetiklenebilir. NH4NO3 patlaması binalara, insanlara ve çevreye ciddi zararlar verebilir. NH4NO3 patlamalarına örnek olarak 1947 Texas City felaketi, 1921 Oppau patlaması, 2015 Tianjin patlaması ve 2020 Beyrut patlaması verilebilir.
S: Amonyum nitrat nasıl satın alınır?
C: NH4NO3 satın almak, yaşadığınız ülke veya bölgeye bağlı olarak lisans veya izin gerektirebilir. Aslında NH4NO3, kamu güvenliğine tehdit oluşturabilecek patlayıcılar veya el yapımı patlayıcı cihazların yapımında kullanılabilir. NH4NO3 satın alırken kimliğinizi, adresinizi, iletişim bilgilerinizi ve ürünün kullanım amacını da vermeniz gerekebilir. NH4NO3, yerel düzenlemelere ve standartlara uygun onaylı tedarikçilerden veya distribütörlerden satın alınabilir. Kazaları veya NH4NO3’ün yanlış kullanımını önlemek için uygun depolama ve taşıma kurallarına da uymalısınız.
