Amonyum karbonat ((NH4)2CO3) bir tuzdur. Amonyak ve karbondioksitin reaksiyona girmesiyle oluşur. Pişirme ve tuz kokulandırma gibi birçok kullanım alanı vardır.
| IUPAC’ın adı | Amonyum karbonat |
| Moleküler formül | (NH4)2CO3 |
| CAS numarası | 506-87-6 |
| Eş anlamlı | fırıncı amonyağı, uçucu tuz, hartshorn tuzu, E503 |
| InChI | InChI=1S/CH203.2H3N/c2-1(3)4;;/h(H2,2,3,4);2*1H3 |
Amonyum karbonatın özellikleri
Amonyum Karbonat Formülü
Amonyum karbonatın kimyasal formülü veya moleküler formülü (NH4) 2CO31’dir . İki amonyum iyonu ve bir karbonat iyonundan oluşan bir tuzdur. İyonların yüklerini göstermek için NH4+ + NH4+ + CO3 2- yazılabilir.
Amonyum Karbonat Molar Kütlesi
(NH4)2CO3’ün molar kütlesi 96,09 g/ mol2’dir . Molar kütleyi hesaplamak için formüldeki tüm atomların atom kütlelerini toplamamız gerekir. Atom kütleleri:
- Azot: 14,01 g/mol
- Hidrojen: 1,01 g/mol
- Karbon: 12,01 g/mol
- Oksijen: 16,00 g/mol
Dolayısıyla amonyum karbonatın molar kütlesi:
(2 x 14,01) + (8 x 1,01) + 12,01 + (3 x 16,00) = 96,09 g/mol
Amonyum karbonatın kaynama noktası
(NH4)2CO3’ün kaynama noktası yoktur çünkü bu sıcaklığa ulaşmadan ayrışır. Isıtıldığında katıdan çıkan amonyak ve karbondioksite ayrışır. Ayrışma reaksiyonu:
(NH4)2CO3 -> 2NH3 + CO2 + H2O
Ayrışma sıcaklığı ortamın nemine ve basıncına bağlıdır ancak genellikle 60°C civarındadır.
Amonyum karbonat Erime noktası
(NH4)2CO3’ün erime noktası 58°C’dir (136°F; 331 K). Ancak bu sıcaklıkta da ayrışır ve bu nedenle sıvı faz oluşturmaz. Bunun yerine doğrudan katıdan gaza süblimleşir.
Amonyum Karbonatın Yoğunluğu g/ml
(NH4)2CO3’ün yoğunluğu 1,50 g/ml’dir. Yoğunluk, bir maddenin birim hacmi başına kütlesidir. Yoğunluğu hesaplamak için kütleyi hacme bölün. Örneğin 10 g (NH4)2CO3 varsa ve 6,67 ml yer kaplıyorsa yoğunluk şöyle olur:
10g / 6,67ml = 1,50g/ml
Amonyum Karbonat Molekül Ağırlığı
(NH4)2CO3’ün moleküler ağırlığı, 96,09 g/mol olan molar kütlesiyle aynıdır. Molekül ağırlığı ve molar kütle sıklıkla birbirinin yerine kullanılır, ancak anlamları biraz farklıdır. Molekül ağırlığı, bir maddenin bir molekülünün kütlesidir; molar kütle ise bir maddenin bir molünün (6,022 x 10^23 molekül) kütlesidir.
Amonyum karbonatın yapısı
(NH4)2CO3’ün yapısı Lewis nokta yapısıyla veya top ve çubuk modeliyle temsil edilebilir. Lewis nokta yapısı, her atomun değerlik elektronlarını ve bunların bağ oluşturmak üzere nasıl paylaşıldığını veya aktarıldığını gösterir. Top ve çubuk modeli, atomların ve bağların şeklini ve düzenini üç boyutlu olarak gösterir.
Amonyum karbonat için olası bir Lewis nokta yapısı şöyledir:
OOOO
|| || ||
HNH HNH HCH
| | |
HHH
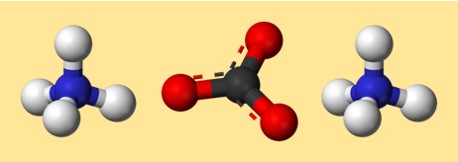
Amonyum karbonat için olası bir model:
Bu modelde her renk farklı bir öğeyi temsil eder:
- Gri: karbon
- Kırmızı: oksijen
- Mavi: nitrojen
- Beyaz: hidrojen
Amonyum karbonatın çözünürlüğü
(NH4)2CO3 suda çözünür. Çözünürlük, bir maddenin başka bir madde içinde çözünme yeteneğidir. (NH4)2CO3 suda çözündüğünde, çözeltideki diğer iyonlarla veya moleküllerle etkileşime girebilen sulu iyonlar oluşturur. Çözünme reaksiyonu:
(NH4)2CO3 + H2O -> 2 NH4+ + CO3 2- + H2O
(NH4)2CO3’ün çözünürlüğü suyun sıcaklığına ve pH’ına bağlıdır. Daha yüksek sıcaklıklarda suda daha fazla (NH4)2CO3 çözünebilir.
| Dış görünüş | Beyaz toz |
| Spesifik yoğunluk | 1.50 |
| Renk | Renksiz |
| Koku | Keskin amonyak kokusu |
| Molar kütle | 96,09 gr/mol |
| Yoğunluk | 1.50g/ml |
| Füzyon noktası | 58°C (136°F; 331K) |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 100g/100ml (15°C) |
| çözünürlük | Su, alkol ve asetonda çözünür |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | 9,25 (NH4+ için) |
| pH | 7,8 (0,1 M’lik bir çözüm için) |
Amonyum karbonatın güvenliği ve tehlikeleri
(NH4)2CO3 ciltte, gözlerde, burunda, boğazda ve akciğerlerde tahrişe ve hasara neden olabilecek tehlikeli bir maddedir. Yutulması halinde de zararlı olabilir. Dikkatli bir şekilde ve eldiven, gözlük ve maske gibi kişisel koruyucu ekipmanlarla kullanılmalıdır. Serin, kuru, iyi havalandırılmış bir alanda, ısıdan, kıvılcımdan ve alevden uzakta saklanmalıdır. Şiddetli reaksiyona girebileceğinden veya zehirli gazlar açığa çıkarabileceğinden güçlü asitler, bazlar veya indirgeyici maddelerle karıştırılmamalıdır. Maruz kalma durumunda derhal tıbbi yardıma başvurun.
| Tehlike sembolleri | Xi (Rahatsız edici) |
| Güvenlik Açıklaması | S22: Tozu solumayın. S24/25: Cilt ve gözlerle temasından kaçının. |
| BM kimlik numaraları | UN3077 |
| HS kodu | 28369910 |
| Tehlike sınıfı | 9 |
| Paketleme grubu | III |
| Toksisite | Oral LD50 sıçan: 2000 mg/kg |
Amonyum karbonat sentez yöntemleri
Başladıkları malzemeye ve ürünün istenen saflığına bağlı olarak farklı yöntemler (NH4)2CO3 sentezleyebilir. (NH4)2CO3 sentezine yönelik bazı yöntem örnekleri:
- Yöntemlerden biri, amonyum sülfatın bir fırında amonyum klorür ve kalsiyum karbonatla reaksiyona sokulmasını içerir. Reaksiyon, yan ürünler olarak (NH4)2CO3 ve kalsiyum klorür üretir. Tepki:
(NH4)2SO4 + 2 NH4Cl + CaCO3 -> 2 (NH4)2CO3 + CaCl2
- Başka bir yöntem, sulu bir çözelti içinde karbondioksit ve amonyakla reaksiyona sokulmasını içerir. Reaksiyon, yan ürün olarak (NH4)2CO3 ve su üretir. Tepki:
CO2 + 2 NH3 + H2O -> (NH4)2CO3 + H2O
- Üçüncü bir yöntem, bir amonyum çözeltisinin karbondioksit içeren havaya maruz bırakılmasını içerir. Amonyum bikarbonat reaksiyonun ürünüdür ve ısıtma onu (NH4)2CO3’e daha da parçalayabilir.
Tepkiler şunlardır:
NH3 + CO2 + H2O -> NH4HCO3
NH4HCO3 -> NH3 + CO2 + H2O
(NH4)2CO3 -> (NH4)2CO3
- Amonyum bikarbonatın havaya maruz kalması ticari kullanım için (NH4)2CO3 üretir. Amonyum bikarbonat, amonyak ve karbondioksite parçalanır ve bunlar tekrar reaksiyona girerek (NH4)2CO3’ü oluşturur. Süreç:
NH4HCO3 -> NH3 + CO2
NH3 + CO2 -> (NH4)2CO3
Amonyum karbonatın kullanım alanları
(NH4)2CO3’ün farklı alanlarda çeşitli kullanımları vardır:
- Fırıncılar bunu özellikle düz veya çıtır bisküviler ve krakerler için bir ayırıcı madde olarak kullanırlar. Hamurun kabarmasına ve hafif bir doku oluşturmasına yardımcı olan karbondioksit ve amonyak gazları üretir. Ayrıca unlu mamullerin lezzetini ve aromasını da arttırır.
- İnsanlar bunu bayılan veya mutsuz hisseden kişileri canlandırmak için kokulu tuz olarak kullanırlar. Burun ve akciğerleri tahriş eden amonyak buharlarını serbest bırakarak solunum sistemini uyarır ve kan basıncını artırır.
- Buckley Öksürük Şurubu gibi bazı öksürük şurupları ve balgam söktürücüler bunu aktif bir madde olarak kullanır. Mukus salgısını arttırarak göğüs ve boğazdaki balgamın gevşemesine ve dışarı atılmasına yardımcı olur.
- Doktorlar zehirlenme veya aşırı doz durumunda kusturmak için kusturucu olarak kullanırlar. Mide zarını tahriş eder ve karbondioksit salarak bulantı ve kusmaya neden olur.
- Kimyacılar bunu üre, amonyum nitrat ve amonyum sülfat sentezi gibi bazı kimyasal reaksiyonlarda reaktif olarak kullanırlar. Ayrıca çözeltilerin pH’ını korumak için tampon görevi görür.
Sorular:
S: Amonyum karbonat asidik mi yoksa bazik mi?
C: (NH4)2CO3 hem asitlerle hem de bazlarla reaksiyona girebilen bir tuzdur. Suda çözündüğünde amonyum iyonları ve karbonat iyonları oluşturur. Amonyum iyonları zayıf asitler gibi davranıp suya proton bağışlayabilirken, karbonat iyonları zayıf bazlar gibi davranıp sudan proton kabul edebilir. Çözeltinin pH’ı amonyum iyonlarının ve karbonat iyonlarının bağıl kuvvetlerine bağlıdır. Karbonat iyonları amonyum iyonlarından daha güçlü bazlar ise çözelti bazik olacaktır. Amonyum iyonları karbonat iyonlarının bazlarından daha güçlü asitlerse çözelti asidik olacaktır. Amonyum iyonları ve karbonat iyonları benzer kuvvetlere sahipse çözelti nötr olacaktır.
Soru: Amonyum karbonat bir tuz mudur?
C: Evet (NH4)2CO3 bir tuzdur. Tuz, asit ve bazın birbirini nötralize etmesiyle oluşan bir bileşiktir. (NH4)2CO3, zayıf bir baz olan amonyak, zayıf bir asit olan karbonik asitle reaksiyona girdiğinde oluşabilir. Tepki:
2NH3 + H2CO3 -> (NH4)2CO3 + H2O
Amonyak ve karbonik asit (NH4)2CO3’ün ana bazı ve asididir.
S: Amonyum karbonatın (sulu) sulu formda kokusu var mıdır?
C: Evet, (NH4)2CO3 (sulu) sulu formda bir kokuya sahiptir. Koku, çözeltiden amonyak gazının salınmasından kaynaklanmaktadır. Amonyak gazının burnu ve akciğerleri tahriş edebilecek keskin bir kokusu vardır. Amonyak gazı uçucu olduğundan ve suda çözünürlüğü düşük olduğundan çözeltiden kaçabilir. Açığa çıkan amonyak gazı miktarı çözeltinin sıcaklığına ve konsantrasyonuna bağlıdır.
Soru: Amonyum karbonat ne tür bir atomdur?
C: (NH4)2CO3 atom değil moleküldür. Bir molekül, elektronları paylaşarak birbirine bağlanan bir grup atomdur. Atom, tanımlanmış bir kimyasal kimliğe sahip maddenin en küçük birimidir. (NH4)2CO3 dört farklı türde atomdan oluşan bir moleküldür: nitrojen, hidrojen, karbon ve oksijen. (NH4)2CO3’ün moleküler formülü (NH4)2CO3’tür.
Soru: Amonyum karbonatta kaç mol vardır?
C: Bu soruyu cevaplamak için kütle veya hacim olarak ne kadar (NH4)2CO3’e sahip olduğumuzu bilmemiz gerekiyor. Bir mol, bir maddenin 6.022 x 10^23 parçacığını temsil eden bir ölçü birimidir. Bir maddenin mol sayısı, kütlesinin molar kütlesine bölünmesiyle veya hacminin molaritesiyle çarpılmasıyla hesaplanabilir. (NH4)2CO3’ün molar kütlesi 96,09 g/mol’dür. (NH4)2CO3’ün molaritesi sudaki çözünürlüğüne bağlıdır.
Örneğin, elimizde 10 g (NH4)2CO3 varsa, mol sayısını 10 g’ı 96,09 g/mol’e bölerek bulabiliriz:
10 g / 96,09 g/mol = 0,104 mol
Elimizde 100 ml 0,1 M (NH4)2CO3 çözeltisi varsa, 100 ml’yi 0,1 mol/L ile çarparak mol sayısını bulabiliriz:
100 ml x 0,1 mol/L = 0,01 mol
S: Amonyum karbonatın kimyasal formülü nedir?
C: Amonyum karbonatın kimyasal formülü (NH4)2CO3’tür. Bu formül, bir (NH4)2CO3 molekülünün iki amonyum iyonu (NH4+) ve bir karbonat iyonu (CO3 2-) içerdiğini gösterir. İyonların yükleri dengede olduğundan molekülün toplam yükü sıfırdır.
Soru: 6,995 g amonyum karbonatta kaç mol amonyum iyonu vardır?
C: Bu soruyu cevaplamak için iki adımı izlememiz gerekiyor:
- Öncelikle 6,995 g’ı molar kütlesine (96,09 g/mol) bölerek 6,995 g’da (NH4)2CO3’ün kaç mol olduğunu bulmamız gerekir:
6,995 g / 96,09 g/mol = 0,0728 mol
- İkincisi, bu sayıyı ikiyle çarpmamız gerekiyor çünkü (NH4)2CO3’ün her molü iki mol amonyum iyonu içerir:
0,0728 mol x 2 = 0,1456 mol
Dolayısıyla 6,995 g (NH4)2CO3’te 0,1456 mol amonyum iyonu bulunur.
S: Hidroklorik asit amonyum karbonatla reaksiyona girdiğinde hangi gaz üretilir?
C: Hidroklorik asit (NH4)2CO3 ile reaksiyona girdiğinde, amonyum klorür ve karbonik asit üretmek için çift yer değiştirme reaksiyonuna girerler. Karbonik asit daha sonra su ve karbondioksite ayrışır. Bu reaksiyon sonucunda ortaya çıkan gaz karbondioksittir. Bu reaksiyonun genel denklemi aşağıdaki gibidir:
(NH4)2CO3 + 2 HCl -> 2 NH4Cl + H2CO3
H2CO3 -> H2O + CO2
Bu reaksiyonun net iyonik denklemi şöyledir:
CO3 2- + 2 H+ -> H2O + CO2
