Amonyum NH4+ nedir?
Amonyum iyonu (NH4+), bir nitrojen atomu ve dört hidrojen atomundan oluşan pozitif yüklü çok atomlu bir iyondur. Genellikle gübrelerde ve organik bileşiklerde bulunur.
| IUPAC Adı | Azanyum |
| Moleküler formül | NH4+ |
| CAS numarası | 14798-03-9 |
| Eş anlamlı | Amonyum katyonu, tetrahidridonitrojen (1+), aminonyum, azanyum, nitrojen hidrit katyonu, hidronitrojen, nitrojen iyonu |
| InChI | InChI=1S/H3N/h1H3/p+1 |
Not: InChI, tek iyonize hidrojen içeren en basit haliyle amonyum iyonuyla ilgilidir. Gerçek InChI, amonyum iyonunun kimyasal ortamına bağlı olarak değişebilir.
Amonyum formülü
Amonyum iyonunun formülü NH4+’dır. Bir nitrojen atomu ve dört hidrojen atomundan oluşan çok atomlu bir katyondur. Amonyum iyonu, amonyağın (NH3) bir hidrojen iyonu (H+) ile protonlanmasıyla oluşur. Amonyum iyonu gübreler, farmasötikler ve patlayıcılar dahil olmak üzere inorganik ve organik bileşiklerde yaygın bir katyondur.
Amonyum katyonu
NH4+ olarak da bilinen amonyum katyonu, bir nitrojen atomu ve dört hidrojen atomundan oluşan pozitif yüklü çok atomlu bir iyondur. Amonyağın (NH3) bir asitten bir proton (H+) almasıyla amonyum tuzunun oluşmasıyla oluşur.
Amonyum iyonlarının molar kütlesi
Amonyum iyonunun (NH4+) molar kütlesi 18,04 g/mol’dür. Bu değer, bir nitrojen atomunun (14,01 g/mol) ve dört hidrojen atomunun (her biri 1,01 g/mol) atomik kütlelerinin eklenmesiyle hesaplanır. Molar kütle, amonyum iyonunun önemli bir özelliğidir çünkü kütlesinin mollere (veya tam tersi) dönüştürülmesine izin verir. Bu, bir kimyasal reaksiyon için gereken reaktanların miktarının belirlenmesi gibi birçok kimyasal hesaplamada faydalıdır.
Amonyum iyonlarının kaynama noktası
Amonyum iyonu genellikle amonyum klorür (NH4Cl) gibi bir tuzda bulunduğundan kendine ait bir kaynama noktasına sahip değildir. Bunun yerine amonyum klorürün 520 °C olan kaynama noktası, amonyum iyonu ile klorür iyonu arasındaki iyonik bağın kuvvetinin yanı sıra amonyum iyonunun boyutu ve şekli gibi çeşitli faktörlerden etkilenir.
Amonyum iyonlarının erime noktası
Kaynama noktasına benzer şekilde amonyum iyonunun da erime noktası yoktur çünkü saf halde bulunan bir madde değildir. Ancak amonyum nitrat (NH4NO3) gibi amonyum iyonu içeren tuzların erime noktası 169,6°C’dir. Amonyum nitratın erime noktası, amonyum iyonu ile nitrat iyonu arasındaki iyonik bağın kuvvetinin yanı sıra bileşiğin kristal yapısından da etkilenir.
Amonyum iyonlarının yoğunluğu g/ml
Amonyum iyonunun (NH4+) yoğunluğu uygulanamaz çünkü çok atomlu bir iyondur ve ayrı bir varlık olarak mevcut değildir. Ancak amonyum sülfat (NH4)2SO4 gibi amonyum iyonu içeren tuzların oda sıcaklığında yoğunluğu 1,77 g/cm³’tür. Amonyum iyonu içeren tuzların yoğunluğu, iyonların boyutu ve şekli, iyonik bağın gücü ve bileşiğin kristal yapısı gibi çeşitli faktörlerden etkilenir.
Amonyum iyonlarının moleküler ağırlığı
Amonyum iyonunun (NH4+) moleküler ağırlığı, bir nitrojen atomu ve dört hidrojen atomunun atomik kütlelerinin eklenmesiyle hesaplanan 18,04 g/mol’dür. Molekül ağırlığı amonyum iyonunun önemli bir özelliğidir çünkü kütlesinin mollere (veya tam tersi) dönüştürülmesine izin verir. Bu, bir kimyasal reaksiyon için gereken reaktanların miktarının belirlenmesi gibi birçok kimyasal hesaplamada faydalıdır.
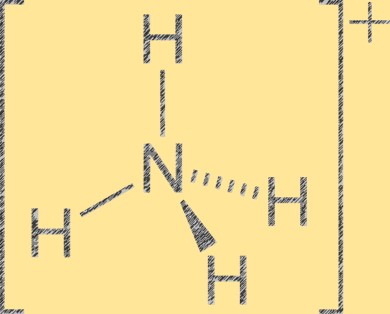
Amonyum iyonlarının yapısı
Amonyum iyonu (NH4+), tetrahedronun merkezinde bir nitrojen atomu ve köşelerinde dört hidrojen atomu bulunan tetrahedral bir moleküler geometriye sahiptir. Nitrojen atomunun pozitif formal yükü +1 iken, her hidrojen atomunun formal yükü -1’dir. Amonyum iyonu, amonyağın (NH3) bir hidrojen iyonu (H+) ile protonlanmasıyla oluşan çok atomlu bir katyondur. Amonyum iyonu gübreler, farmasötikler ve patlayıcılar dahil olmak üzere inorganik ve organik bileşiklerde yaygın bir katyondur.
| Dış görünüş | Beyaz veya renksiz kristal katı gaz |
| Spesifik yer çekimi | Uygulanamaz (çok atomlu iyon) |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 18,04 gr/mol |
| Yoğunluk | Uygulanamaz (çok atomlu iyon), tuz yoğunluğu değişiklik gösterir (örn. amonyum sülfat için 1,77 g/cm³) |
| Füzyon noktası | Uygulanamaz (çok atomlu iyon), tuzların erime noktası değişiklik gösterir (örn. amonyum nitrat için 169,6°C) |
| Kaynama noktası | Uygulanamaz (çok atomlu iyon), tuzların kaynama noktası değişir (örn. amonyum klorür için 520 °C) |
| Flaş noktası | Uygulanamaz (çok atomlu iyon) |
| sudaki çözünürlük | Suda çok çözünür (tamamen karışabilir) |
| çözünürlük | Alkollerde ve sıvı amonyakta çözünür |
| Buhar basıncı | Uygulanamaz (çok atomlu iyon) |
| Buhar yoğunluğu | Uygulanamaz (çok atomlu iyon) |
| pKa | 9.25 (konjuge asit, amonyum katyonu) |
| pH | 7 (nötr) sulu çözeltide |
Not: Tabloda sunulan değerler, amonyum iyonunun kimyasal formuna ve özel koşullarına bağlı olarak değişiklik gösterebilir.
Amonyum iyonlarının güvenliği ve tehlikeleri
Amonyum iyonunun saf haliyle genellikle güvenli ve toksik olmadığı kabul edilir. Ancak birçok kimyasal bileşik gibi amonyum iyonu da, özellikle uygunsuz şekilde kullanıldığında veya kullanıldığında belirli tehlikeler ve riskler oluşturabilir. Amonyum iyonu güçlü bazlar veya güçlü asitlerle reaksiyona girdiğinde zehirli amonyak gazı açığa çıkarabilir. Ayrıca ısıya veya aleve maruz kaldığında yangın ve patlama tehlikesi oluşturabilir. Ayrıca yüksek konsantrasyonlarda amonyum iyonlarına veya türevlerine maruz kalmak gözlerde, ciltte ve solunum sisteminde tahrişe neden olabilir. Potansiyel tehlikelerden kaçınmak için uygun güvenlik protokollerini takip etmek ve amonyum iyonu ve türevlerini dikkatli bir şekilde kullanmak önemlidir.
| Tehlike sembolleri | Saf amonyum iyonu için atanan yok |
| Güvenlik Açıklaması | Yutulması, solunması veya deri yoluyla emilmesi halinde zararlıdır. Ciltte, gözlerde ve solunum yollarında tahrişe neden olur. Zehirli amonyak gazı açığa çıkarabilir. Yangın ve patlama tehlikesi oluşturabilir. |
| BİR KİMLİK | 3077 (amonyum tuzları dahil amonyum bileşikleri için) |
| HS kodu | 2827.10.00 (amonyum klorür, amonyum karbonat ve diğer amonyum tuzları için) |
| Tehlike sınıfı | Amonyum bileşikleri için 9 (Çeşitli tehlikeli maddeler ve nesneler), amonyum hidroksit çözeltisi için Sınıf 8 (Aşındırıcı maddeler) |
| Paketleme grubu | III (amonyum bileşikleri için) |
| Toksisite | Genellikle saf haliyle toksik olmadığı kabul edilir, ancak toksik amonyak gazı açığa çıkarabilir. Amonyum bileşikleri ve türevleri, spesifik özelliklerine ve kullanım alanlarına bağlı olarak insan sağlığına ve çevreye toksik veya zararlı olabilir. |
Amonyum iyonlarının sentezi için yöntemler
Amonyum iyonu, kimyasal reaksiyonlar ve biyolojik süreçler dahil olmak üzere çeşitli yöntemler kullanılarak sentezlenebilir.
Amonyum iyonunu sentezlemenin yaygın bir yöntemi, amonyak gazını hidroklorik asit veya sülfürik asit gibi bir asitle reaksiyona sokarak amonyum tuzu üretmektir. Reaksiyon, asitteki hidrojen iyonlarının (H+) amonyak molekülleri tarafından yer değiştirmesini içerir, bu da amonyum katyonunun (NH4+) ve asidin karşılık gelen anyonunun (örn. klorür, sülfat) oluşmasıyla sonuçlanır. Ortaya çıkan amonyum tuzu, bir amonyum iyonu elde etmek üzere saflaştırılabilir ve kristalleştirilebilir.
Organik maddenin mikroplar tarafından parçalanması gibi biyolojik süreçler de amonyum iyonlarının oluşmasıyla sonuçlanabilir. Bu işlem sırasında nitrojen içeren bileşikler bakteriler ve diğer mikroorganizmalar tarafından parçalanarak amonyak ve sonunda amonyum iyonları üretilir. Bu işlem amonifikasyon olarak bilinir ve nitrojen döngüsünde önemli bir adımdır.
Amonyum iyonunu sentezlemenin bir başka yöntemi, nitrojen gazı ile hidrojen gazının bir katalizör varlığında yüksek basınç ve sıcaklıkta reaksiyonunu içeren Haber-Bosch işleminin kullanılmasıdır. Ortaya çıkan amonyak gazı daha sonra bir asitle reaksiyona girerek bir amonyum iyonu oluşturabilir.
Amonyum iyonlarının kullanımı
Amonyum iyonunun endüstriyel, tarımsal ve laboratuvar ortamlarında çeşitli kullanımları vardır.
Tarımda öncelikli olarak gübre görevi görerek bitkilere hazır nitrojen sağlarken toprak pH’ını düşürdüğünden çok çeşitli endüstriyel, tarım ve laboratuvar ortamlarına hizmet eder.
Kimya endüstrisi, amonyum iyonunu gübreler, patlayıcılar ve farmasötik ürünler gibi çeşitli bileşiklerin üretiminde ve ayrıca antibiyotiklerin ve diğer farmasötik ilaçların sentezinde önemli bir bileşen olarak kullanır. Amonyum iyonu ayrıca amonyum nitrat formunda patlayıcı olarak da işlev görür.
Laboratuvarlarda araştırmacılar, amonyum iyonunu çökeltme reaksiyonları ve organik sentez gibi birçok kimyasal reaksiyonda reaktan olarak ve çözeltinin pH’ını stabilize etmek için bir tamponlama maddesi olarak kullanırlar.
Ayrıca amonyum iyonu, bakteri ve mantarları öldürme özelliğinden dolayı ev temizlik ürünlerinde antimikrobiyal madde olarak kullanılmaktadır.
Amonyum iyonunun çoklu kullanımı ve çok yönlülüğü, onu çeşitli endüstrilerde ve uygulamalarda önemli bir bileşik haline getirmektedir.
