Amonyum bikarbonat, pişirme işleminde ayırıcı madde olarak kullanılan beyaz kristalli bir bileşiktir. Isıtıldığında karbondioksit açığa çıkarır ve böylece hafif ve yumuşak hamur işleri elde edilir.
| IUPAC Adı | Amonyum bikarbonat |
| Moleküler formül | NH4HCO3 |
| CAS numarası | 1066-33-7 |
| Eş anlamlı | Asidik amonyum karbonat; fırın amonyağı; Karbonik asidin amonyum tuzu (1:1); Amonyum hidrojen karbonat |
| InChI | InChI=1S/CH2O3.H3N/c2-1(3)4;/h(H2,2,3,4);1H3 |
Sağlanan InChI değerinin basitleştirilmiş bir gösterim olduğunu ve tam olmayabileceğini lütfen unutmayın.
Amonyum bikarbonatın özellikleri
Amonyum Bikarbonat Formülü
Amonyum bikarbonatın kimyasal formülü NH4HCO3’tür. Bir amonyum iyonu (NH4+) ve bir bikarbonat iyonundan (HCO3-) oluşur. Bu formül bileşiğin bileşimini temsil eder ve amonyum ve bikarbonat gruplarının varlığını gösterir.
Amonyum Bikarbonat Molar Kütlesi
Amonyum hidrojen karbonatın molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanır. Amonyum hidrojen karbonatın (NH4HCO3) molar kütlesi mol başına yaklaşık 79,06 gramdır. Bu değer çeşitli kimyasal hesaplamalar ve dönüşümler için önemlidir.
Amonyum bikarbonatın kaynama noktası
Amonyum hidrojen karbonat, ısıtıldığında gaz halindeki ürünlere ayrıştığı için belirgin bir kaynama noktasına sahip değildir. Ancak ayrışma süreci 60 ila 70 santigrat derece civarında başlar. Sıcaklık arttıkça bileşik amonyak (NH3), su (H2O) ve karbondioksite (CO2) ayrışır.
Amonyum Bikarbonat Erime Noktası
Amonyum hidrojen karbonatın erime noktası yaklaşık 41 ila 60 santigrat derecedir. Bileşik ısıtıldığında süblimleşmeye uğrar ve sıvı fazdan geçmeden doğrudan katı halden gaz haline geçer.
Amonyum bikarbonatın yoğunluğu g/mL
Amonyum hidrojen karbonatın yoğunluğu, oda sıcaklığında mililitre başına yaklaşık 1,59 gramdır (g/mL). Bu değer, bileşiğin birim hacim başına kütlesini temsil eder. Amonyum hidrojen karbonatın yoğunluğu, çeşitli uygulamalardaki davranışını ve farklı çözücüler içindeki çözünürlüğünü etkiler.
Amonyum Bikarbonat Molekül Ağırlığı
Amonyum hidrojen karbonatın moleküler ağırlığı mol başına yaklaşık 79.06 gramdır. Bu değer, bileşikte bulunan elementlerin (azot, hidrojen, karbon ve oksijen) atomik kütlelerinin eklenmesiyle elde edilir. Kimyasal reaksiyonlar için gerekli amonyum hidrojen karbonat miktarının hesaplanmasında molekül ağırlığı önemlidir.
Amonyum bikarbonatın yapısı
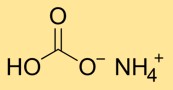
Amonyum hidrojen karbonat, amonyum (NH4+) ve bikarbonat (HCO3-) iyonlarından oluşan bir kristal yapıya sahiptir. Amonyum iyonu bir nitrojen atomu ve dört hidrojen atomunun birleşiminden oluşurken, bikarbonat iyonu üç oksijen atomuna bağlı bir karbon atomundan oluşur.
Amonyum bikarbonatın çözünürlüğü
Amonyum hidrojen karbonat suda çok çözünür. Sulu çözeltilerde kolayca çözünür, amonyum iyonları ve bikarbonat iyonları açığa çıkar. Ancak sıcaklık arttıkça çözünürlüğü azalır. Alkolde az çözünür ve çoğu organik çözücüde çözünmez.
| Dış görünüş | Beyaz kristal toz |
| Spesifik yer çekimi | 1.586 g/cm³ |
| Renk | Renksiz |
| Koku | Amonyak kokusu |
| Molar kütle | 79,06 gr/mol |
| Yoğunluk | 1,59 gr/ml |
| Füzyon noktası | 41-60°C |
| Kaynama noktası | ayrıştırılmış |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çözünür |
| çözünürlük | Suda çözünebilir; alkolde az çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | ~7 |
Lütfen verilen değerlerin yaklaşık olduğunu ve saflık ve çevre koşulları gibi faktörlere bağlı olarak değişebileceğini unutmayın.
Amonyum bikarbonatın güvenliği ve tehlikeleri
Amonyum hidrojen karbonat bazı güvenlik hususlarını ve tehlikeleri beraberinde getirir. Temas veya solunması halinde gözleri, cildi ve solunum sistemini tahriş edebilir. Doğrudan maruz kalma, yanma hissi de dahil olmak üzere rahatsızlığa neden olabilir. Bileşiğin dikkatli bir şekilde kullanılması ve eldiven ve gözlük gibi uygun kişisel koruyucu ekipmanların kullanılması önemlidir. Ayrıca amonyum hidrojen karbonat ısıtıldığında zararlı amonyak gazı açığa çıkarabileceğinden bu gibi durumlarda yeterli havalandırma gereklidir. Bileşik yanıcı değildir ve belirli bir parlama noktasına sahip değildir. Amonyum hidrojen karbonatın işlenmesi ve kullanılmasıyla ilişkili risklerin en aza indirilmesi için uygun depolama, etiketleme ve güvenlik protokollerine bağlılık şarttır.
| Tehlike sembolleri | Xi (Rahatsız edici) |
| Güvenlik Açıklaması | – Gözlerle, ciltle temasından ve solumaktan kaçının.\n- Uygun kişisel koruyucu ekipman kullanın.\n- Taşıma sırasında yeterli havalandırma olduğundan emin olun.\n- Uygun şekilde saklayın ve kapları etiketleyin.\n – Güvenlik protokollerini izleyin. |
| BM kimlik numaraları | Uygulanamaz |
| HS kodu | 28369990 |
| Tehlike sınıfı | sınıflandırılmamış |
| Paketleme grubu | sınıflandırılmamış |
| Toksisite | Düşük toksisite; gözleri, cildi ve solunum sistemini tahriş eder. |
Sağlanan bilgilerin doğası gereği genel olduğunu ve amonyum hidrojen karbonatın güvenliği ve tehlikelerinin tüm yönlerini kapsamayabileceğini lütfen unutmayın. Tam rehberlik için özel güvenlik veri sayfalarına ve düzenlemelere başvurmak önemlidir.
Amonyum bikarbonatın sentezi için yöntemler
Amonyum hidrojen karbonatın sentezlenmesi için çeşitli yöntemler vardır.
Yaygın bir yöntem, sulu bir çözelti içinde gaz halindeki amonyak (NH3) ile karbon dioksit (CO2) arasındaki reaksiyonu içerir. Bu işlemde, iki gazı doğrudan suya kabarcıklandırırsınız ve su, bir amonyum hidrojen karbonat çözeltisi oluşturur. Daha sonra katı bileşiği elde etmek için çözeltiyi konsantre edip kristalleştirirsiniz.
Diğer bir yaklaşım ise metanol veya etanol gibi bir çözücü içerisinde amonyak ile karbon dioksit arasındaki reaksiyondur. Reaksiyon basınç altında ve yüksek sıcaklıkta gerçekleşir ve amonyum hidrojen karbonat kristallerinin oluşmasıyla sonuçlanır.
Amonyum karbonatın karbondioksit ile işlenmesi amonyum bikarbonat ve su üretir. Amonyum karbonat , ister katı ister çözelti halinde olsun, karbondioksit ile reaksiyona girerek amonyum bikarbonat üretir.
Amonyum hidrojen karbonatın sentezlenmesi için amonyak karbonik asit ile birleştirilebilir. Karbonik asit, karbondioksitin suda çözülmesiyle oluşturulur ve elde edilen karbonik asit çözeltisine amonyak eklenerek amonyum hidrojen karbonat üretilir.
Reaksiyonlar sırasında amonyak gazı açığa çıkması nedeniyle amonyum hidrojen karbonat sentezinin iyi havalandırılan bir alanda gerçekleştiğinden emin olun. Güvenli ve verimli bir sentez süreci sağlamak için uygun güvenlik önlemlerini ve işleme protokollerini izleyin.
Amonyum Bikarbonatın Kullanım Alanları
Amonyum hidrojen karbonat, farklı endüstrilerde ve uygulamalarda çeşitli kullanım alanları bulur. Yaygın kullanımlarından bazıları şunlardır:
- Pişirme: Amonyum hidrojen karbonat, özellikle kurabiyeler, krakerler ve diğer fırınlanmış ürünler için pişirme işleminde bir ayırıcı madde olarak kullanılır. Isıtıldığında karbondioksit açığa çıkararak hafif, gevrek bir doku oluşturur.
- Amonyak Üretimi: Amonyum hidrojen karbonat, amonyak üretiminde ara bileşik olarak görev yapar. Amonyak ve karbondioksite parçalanabilir ve bunlar daha sonra ayrılıp çeşitli amaçlar için kullanılabilir.
- Tarım: Çiftçiler bunu bitki büyümesi için gerekli besinleri sağlamak amacıyla gübrelerde nitrojen kaynağı olarak kullanırlar. Sudaki çözünürlüğü sayesinde bitkiler kolaylıkla emer.
- pH Kontrolü: Endüstriler, su arıtma, boya üretimi ve pigment üretimi gibi işlemlerde pH seviyelerini ayarlamak için amonyum hidrojen karbonat kullanır.
- Yangın Söndürücüler: Bazı kuru tozlu yangın söndürücüler bu bileşiği yangın söndürücü olarak kullanır. Alevleri söndürür ve yanma sürecini bozar.
- Temizlik Maddesi: Bazı endüstriler bunu yüzeylerden kiri, yağı ve kirletici maddeleri çıkarmak için bir temizlik maddesi olarak kullanır.
- Tekstil ve deri endüstrisi: Tekstil ve deri eşyaların boyama ve baskı proseslerinde amonyum hidrojen karbonat, boyaların sabitlenmesine ve renk haslığının arttırılmasına yardımcı olur.
- Farmasötik uygulamalar: Bazı farmasötik formülasyonlarda, tıbbi tabletlerde tamponlayıcı madde veya bileşen olarak uygulama alanı bulur.
Amonyum hidrojen karbonatın çeşitli uygulamaları, fırıncılık, tarım, pH kontrolü, yangın söndürme ve çeşitli üretim süreçleri dahil olmak üzere birçok endüstrideki çok yönlülüğünü ve kullanışlılığını vurgulamaktadır.
Sorular:
S: Amonyum bikarbonat sizin için kötü mü?
C: Amonyum hidrojen karbonat, büyük miktarlarda yutulması veya solunması halinde zararlı olabilir, solunum sistemi ve ciltte tahrişe neden olabilir. Uygun önlemler alınarak kullanılmalı ve kullanılmalıdır.
S: Amonyum karbonat amonyum bikarbonattan nasıl ayrılır?
C: Amonyum karbonat, karışımın ısıtılmasıyla amonyum hidrojen karbonattan ayrılabilir, çünkü amonyum bikarbonat amonyak, karbondioksit ve suya ayrışır ve geride amonyum karbonat kalır.
S: Sudaki amonyum bikarbonatın pH’ını nasıl hesaplarsınız?
A: Sudaki amonyum hidrojen karbonatın pH’ı Henderson-Hasselbalch denklemi kullanılarak hesaplanabilir: pH = pKa + log([A-]/[HA]), burada pKa asit ayrışma sabitidir ve [A-]/[ HA] konjuge bazın asit oranını temsil eder.
S: Amonyum bikarbonat tamponunun pH’ını nasıl ayarlayabilirim?
C: Amonyum hidrojen karbonat tamponunun pH’ı, amonyum bikarbonatın konjuge bazına uygun oranı korunurken pH’ı düşürmek için güçlü bir asit veya pH’ı artırmak için güçlü bir baz eklenerek ayarlanabilir.
S: Amonyum bikarbonat gıdalarda güvenli midir?
C: Amonyum hidrojen karbonatın gıdalarda kullanımı genellikle güvenli (GRAS) olarak kabul edilmektedir, ancak düzenleyici kurallara göre ve uygun miktarlarda kullanılmalıdır.
S: Amonyum bikarbonat tamponu nedir?
C: Amonyum hidrojen karbonat tamponu, çeşitli biyokimyasal ve biyolojik uygulamalarda stabil bir pH’ı korumak için kullanılan, amonyum hidrojen karbonat ve bunun konjuge bazını (veya asidini) içeren bir çözeltidir.
S: Amonyum bikarbonatın moleküler kütlesi nedir?
A: Amonyum hidrojen karbonatın moleküler kütlesi yaklaşık 79,06 g/mol’dür.
S: NH4HCO3’teki hidrojenin kütlesel yüzde bileşimi nedir?
C: NH4HCO3’teki hidrojenin kütle yüzdesi bileşimi yaklaşık %6,57’dir.
S: NH4HCO3 asit mi yoksa baz mı?
C: NH4HCO3, bağlama bağlı olarak hem asit hem de baz görevi görebilir. Asit görevi görmesi için bir proton (H+) bağışlayabilir veya baz görevi görmesi için bir proton kabul edebilir.
Soru: NH4HCO3 formülüne sahip bileşiğin adı nedir?
C: NH4HCO3 formülüne sahip bileşiğe amonyum hidrojenkarbonat adı verilir.
S: NH4HCO3 iyonik mi yoksa kovalent mi?
C: NH4HCO3, yapısında amonyum iyonu (NH4+) ve hidrojen karbonat iyonu (HCO3-) bulunması nedeniyle iyonik bir bileşik olarak kabul edilir.
