Amonyum asetat çeşitli endüstrilerde kullanılan bir bileşiktir. Asetat iyonlarının kaynağı olarak görev yapar ve kimyasal reaksiyonlarda ve organik sentezde rol oynar.
| IUPAC Adı | Amonyum asetat |
| Moleküler formül | C2H7NO2 |
| CAS numarası | 631-61-8 |
| Eş anlamlı | Asetik asitin amonyum tuzu, amonyum etanoat, amonyum asetik asit, asetik asit, amonyum tuzu |
| InChI | InChI=1S/C2H4O2.H3N/c1-2(3)4;/h1H3,(H,3,4);1H3 |
Amonyum asetatın özellikleri
Amonyum Asetat Formülü
Asetik asitin amonyum tuzunun formülü C2H7NO2’dir. İki karbon atomu, yedi hidrojen atomu, bir nitrojen atomu ve iki oksijen atomundan oluşur.
Amonyum Asetat Molar Kütlesi
Asetik asitin amonyum tuzunun molar kütlesi, onu oluşturan elementlerin atomik kütlelerinin eklenmesiyle hesaplanır. Bu, mol başına yaklaşık 77.0825 gramdır.
Amonyum asetatın kaynama noktası
Asetik asitin amonyum tuzunun kaynama noktası yaklaşık 117 santigrat derecedir. Bu sıcaklıkta bileşik sıvıdan gaza faz değişimine uğrar.
Amonyum asetat Erime noktası
Asetik asitin amonyum tuzunun erime noktası yaklaşık 114 santigrat derecedir. Bu, katı bileşiğin sıvı duruma geçtiği sıcaklıktır.
Amonyum asetatın yoğunluğu g/mL
Asetik asitin amonyum tuzunun yoğunluğu mililitre başına yaklaşık 1,17 gramdır. Bileşiğin birim hacmi başına kütlenin bir ölçüsüdür.
Amonyum Asetat Molekül Ağırlığı
Asetik asitin amonyum tuzunun moleküler ağırlığı mol başına yaklaşık 77.0825 gramdır. Bileşikte bulunan tüm atomların atom ağırlıklarının toplamıdır.
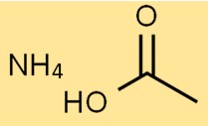
Amonyum asetatın yapısı
Asetik asitin amonyum tuzunun yapısı bir NH4+ iyonu ve bir CH3COO- iyonundan oluşur. NH4+ iyonu pozitif yüklüyken CH3COO- iyonu negatif yüklüdür.
Amonyum asetatın çözünürlüğü
Asetik asitin amonyum tuzu suda oldukça çözünür. Berrak, renksiz bir çözelti oluşturmak için suda kolayca çözünür. Asetik asitin amonyum tuzunun sudaki çözünürlüğü, su molekülleri ile hidrojen bağları oluşturma yeteneğinden kaynaklanmaktadır.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 1.17g/ml |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 77.0825 gr/mol |
| Yoğunluk | 1.17g/ml |
| Füzyon noktası | 114°C |
| Kaynama noktası | 117°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | suda çok çözünür |
| çözünürlük | Suda, asetik asitte, etanolde çözünür |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | 4.75 |
| pH | Yaklaşık 6.0-7.0 |
Amonyum asetatın güvenliği ve tehlikeleri
Asetik asidin amonyum tuzu, doğru kullanıldığında minimum güvenlik riski oluşturur. Çeşitli uygulamalarda kullanımı genellikle güvenli kabul edilir. Ancak her kimyasalda olduğu gibi bu konuda da önlem alınması gerekiyor. Solunum yolu tahrişine neden olabileceğinden tozları veya buharları solumaktan kaçının. Asetik asitin amonyum tuzu ile çalışırken eldiven ve koruyucu gözlük dahil uygun kişisel koruyucu ekipmanın kullanılması tavsiye edilir. Kazara yutulması veya göz veya cilt ile teması halinde bol su ile yıkayın ve gerekirse doktora başvurun. Asetik asitin amonyum tuzunu, uyumsuz maddelerden uzakta, serin ve kuru bir yerde saklayın. Güvenliği sağlamak için uygun taşıma ve imha prosedürlerini izleyin.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Düşük toksisite |
| BM kimlik numaraları | Düzenlenmemiş |
| HS kodu | 2915.29.10 |
| Tehlike sınıfı | Asetik asitin amonyum tuzu sınıflandırılmamıştır |
| Paketleme grubu | Uygulanamaz |
| Toksisite | Düşük toksisite |
Amonyum asetatın sentezi için yöntemler
Asetik asidin amonyum tuzunu sentezlemek için çeşitli yöntemler vardır. Yaygın bir yaklaşım, asetik asidin sulu bir amonyum karbonat çözeltisiyle karıştırılmasıdır. Aralarındaki reaksiyon amonyum tuzu ve asetik su üretir. Bu yöntem reaksiyon sırasında sıcaklık ve basıncın kontrol edilmesini gerektirir.
Başka bir yöntemde kimyagerler, bir amonyak çözeltisine kademeli olarak asetik asit eklerken, istenen pH’a ulaşılana kadar karıştırırlar. Bu nötrleştirme işlemi asetik asidi asetik asidin amonyum tuzuna dönüştürür. Bu reaksiyon sırasında dikkatli karıştırma ve pH kontrolü önemlidir.
Asetik asitin amonyum tuzunu asetik asitle birleştirerek sentezlemek için amonyum hidroksit kullanın, bu da asetik asit ve suyun amonyum tuzunun oluşmasına neden olur. Tamamlanana kadar bu reaksiyonun ilerleyişini izleyin.
Asetik asidin amonyum tuzunu hazırlamak için asetik anhidriti amonyum hidroksit veya amonyakla karıştırın. Bu reaktifler arasındaki reaksiyon, asetik asidin amonyum tuzunun oluşmasıyla sonuçlanır.
Asetik asitin amonyum tuzunun sentezinin iyi havalandırılmış bir alanda gerçekleştirilmesinin ve uygun güvenlik önlemlerinin alınmasının önemli olduğunu unutmayın. Sentez süreci boyunca kimyasalların uygun şekilde işlenmesini ve depolanmasını sağlayın.
Amonyum Asetatın Kullanım Alanları
Asetik asitin amonyum tuzu, çok yönlü özelliklerinden dolayı farklı endüstrilerde çeşitli uygulamalar bulur. İşte bazı yaygın kullanımlar:
- Asetik asitin amonyum tuzu çözeltileri tamponlar ve kimyasal ve biyolojik laboratuvarlarda stabil bir pH seviyesini korur.
- Kromatografi ve kütle spektrometresi gibi analitik yöntemler, bileşiklerin iyonizasyonu ve ayrılması için bir reaktif olarak asetik asidin amonyum tuzunu kullanır.
- Moleküler biyoloji, saflaştırma prosedürleri sırasında DNA’yı çökeltmek için asetik asitin amonyum tuzunu kullanır, böylece kirletici maddeler ve safsızlıklar giderilir.
- Asetik asidin amonyum tuzu birçok kimyasal reaksiyona katılarak organik sentezde, esterleşme reaksiyonlarında ve katalitik işlemlerde asetat iyonlarının kaynağı olarak görev yapar.
- Tarımda asetik asitin amonyum tuzu, gübrelerde nitrojen kaynağı olarak görev yaparak bitki büyümesini ve gelişmesini destekler.
- Tekstil endüstrileri, kumaşları boyamak ve basmak için asetik asitin amonyum tuzunu kullanır, böylece boyaları kumaşa sabitleyerek renk haslığını artırır.
- Gıda endüstrisi, çeşitli gıda ürünlerinin pH’ını kontrol etmek için asitliği düzenleyen bir gıda katkı maddesi olarak asetik asitin amonyum tuzunu onaylamaktadır.
- HPLC (yüksek performanslı sıvı kromatografisi) gibi kimyasal analiz tekniklerinde asetik asidin amonyum tuzu, bileşiklerin ayrılmasını ve tespit edilmesini kolaylaştırır.
Genel olarak asetik asitin amonyum tuzu, laboratuvar uygulamalarından tarıma ve gıda endüstrisine kadar değişen kullanımları olan çok yönlü bir bileşiktir. Eşsiz özellikleri onu çeşitli işlemlerde ve ürünlerde önemli bir bileşen haline getirir.
Sorular:
S: Bir amonyum asetat molekülü NH4C2H3O2’de kaç tane hidrojen atomu vardır?
C: Asetik asitin amonyum tuzunun (NH4C2H3O2) bir molekülünde dört hidrojen atomu vardır.
S: Amonyum asetat çözünür mü?
C: Evet, asetik asitin amonyum tuzu suda çözünür.
S: Amonyum asetatın formülü nedir?
A: Asetik asitin amonyum tuzunun formülü NH4C2H3O2’dir.
S: Amonyum asetat suda çözünür mü?
C: Evet, asetik asitin amonyum tuzu suda çözünür.
S: 1M amonyum asetat nasıl hazırlanır?
A: Asetik asitin 1M amonyum tuzunu hazırlamak için, litre başına 1 mol (M) konsantrasyon elde etmek için uygun miktarda amonyum asetatı suda çözün.
Soru: 0,624 mol amonyum asetat suda çözündüğünde toplam kaç mol iyon açığa çıkar?
A: Asetik asitin 0,624 mol amonyum tuzu suda çözündüğünde toplam 1,248 mol iyon (NH4+ ve C2H3O2-) açığa çıkar.
S: Amonyum asetatın (NH4OAc) tam moleküler ağırlığı nedir?
C: Asetik asitin amonyum tuzunun (NH4OAc) tam moleküler ağırlığı mol başına yaklaşık 77.0825 gramdır.
S: 5M amonyum asetat nasıl yapılır?
C: Asetik asidin 5M amonyum tuzunu hazırlamak için, litre başına 5 mol (M) konsantrasyona ulaşmak için uygun miktarda amonyum asetatı suda çözün.
S: Asetik asitin pKa’sı ve amonyum hidroksitin pKb’si nedir?
C: Asetik asidin pKa’sı yaklaşık 4,75’tir ve asetik asidin amonyum tuzunun pKb’si yaklaşık 4,25’tir.
