Amonyak nedir?
Amonyak veya NH3, endüstride soğutucu, temizlik maddesi ve gübre olarak yaygın olarak kullanılan, nitrojen ve hidrojenden oluşan renksiz, keskin bir gazdır.
| IUPAC Adı | Amonyak |
| Moleküler formül | NH3 |
| CAS numarası | 7664-41-7 |
| Eş anlamlı | Azan, nitrojen trihidrit, Hartshorn alkol |
| InChI | InChI=1S/NH3/c1-2 |
Amonyağın özellikleri
Amonyak için Lewis yapısı
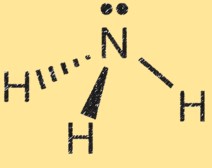
Amonyağın (NH3) Lewis yapısı moleküldeki elektronların dizilişini gösterir. Lewis yapısında noktalar elektronları, çizgiler ise atomlar arasındaki bağları temsil eder.
Amonyağın Lewis yapısı, nitrojen atomunun üç hidrojen atomu ile çevrelenmiş olduğunu ve nitrojen ve hidrojen atomları arasında paylaşılan bir çift elektronu gösterir. Bu moleküldeki kovalent bağları temsil eder. Azot atomunun beş değerlik elektronu vardır ve hidrojen atomlarının her birinin bir değerlik elektronu vardır. Amonyağın Lewis yapısında nitrojen atomu, hidrojen atomlarıyla üç tekli bağ oluşturur ve bir ortaklanmamış elektron çiftine sahiptir.
Amonyak Formülü
Amonyağın kimyasal formülü NH3’tür. Formül, her amonyak molekülünde üç hidrojen atomu ve bir nitrojen atomu bulunduğunu gösterir. Formül, maddenin bileşimini temsil eder ve özellikleri ve davranışı hakkında önemli bilgiler sağlar.
NH3 Molar kütle
Bir maddenin molar kütlesi, maddenin bir molünün kütlesidir ve mol başına gram cinsinden ifade edilir. Amonyağın (NH3) molar kütlesi 17.0307 g/mol’dür. Bu, bir mol amonyağın kütlesinin 17.0307 gram olduğu anlamına gelir. Bir maddenin molar kütlesi, belirli bir numunedeki mol sayısının belirlenmesinde önemlidir ve bir bileşiğin formül kütlesinin belirlenmesinde kullanılabilir.
Amonyağın kaynama noktası
NH3’ün kaynama noktası -33,34°C’dir (-28,012°F). Bir maddenin kaynama noktası, maddenin buhar basıncının atmosfer basıncına eşit olduğu ve sıvı halden gaz haline geçmeye başladığı sıcaklıktır. NH3’ün kaynama noktası diğer kimyasallarla karşılaştırıldığında nispeten düşüktür, bu da onu soğutma ve soğutma sistemlerinde faydalı bir soğutucu yapar.
NH3 Erime noktası
NH3’ün erime noktası -77,73°C’dir (-107,87°F). Bir maddenin erime noktası, onun katı halden sıvı hale geçtiği sıcaklıktır. NH3’ün düşük erime noktası, gazdan sıvıya kolaylıkla yoğunlaşabilmesi ve hal değiştirirken ısıyı absorbe edebilmesi nedeniyle onu yararlı bir soğutucu haline getirir.
NH3 Yoğunluğu g/ml
Bir maddenin yoğunluğu, birim hacim başına bir numunenin kütlesidir. NH3’ün yoğunluğu 0,769 g/mL’dir. Bu, bir mililitre NH3’ün kütlesinin 0,769 gram olduğu anlamına gelir. Bir maddenin yoğunluğu, belirli bir hacimde bulunan madde miktarını belirlemek için kullanılabilir ve bir maddenin farklı durumlarda nasıl davrandığını anlamak için önemli bir özelliktir.
NH3 Molekül Ağırlığı
Bir maddenin moleküler ağırlığı, o maddenin tek bir molekülündeki tüm atomların atom ağırlıklarının toplamıdır. NH3’ün (NH3) molekül ağırlığı 17.0307 g/mol’dür. Bu, bir NH3 molekülünün mol başına 17.0307 gram moleküler ağırlığa sahip olduğu anlamına gelir. Bir maddenin moleküler ağırlığı, belirli bir numunedeki mol sayısının belirlenmesinde önemlidir ve bir bileşiğin formül kütlesinin belirlenmesinde kullanılabilir.
NH3 yapısı
NH3, üç hidrojen atomu ve bir nitrojen atomundan oluşan bir moleküldür. Azot atomu, hidrojen atomlarına kovalent bir bağ yoluyla bağlanır ve molekül, üçgen piramit şekline sahiptir. Moleküldeki bağ açıları yaklaşık 107°’dir. NH3 polar bir moleküldür, yani pozitif ve negatif uçları vardır ve kimyasal reaksiyonlarda genellikle çözücü ve reaktif olarak kullanılır.
| Dış görünüş | Renksiz gaz |
| Spesifik yer çekimi | 0,59 (hava = 1) |
| Renk | Renksiz |
| Koku | Keskin ve güçlü koku |
| Molar kütle | 17.0307 gr/mol |
| Yoğunluk | 0,769 g/mL |
| Füzyon noktası | -77.73°C |
| Kaynama noktası | -33.34°C |
| Flaş noktası | Uygulanamaz (gaz) |
| sudaki çözünürlük | Çok çözünür |
| çözünürlük | Suda ve çoğu organik çözücüde çözünür |
| Buhar basıncı | 20°C’de 50,7 kPa |
| Buhar yoğunluğu | 0,59 (hava = 1) |
| pKa | 4.75 |
| pH | 11.6 (doymuş çözelti) |
Amonyak Güvenliği ve Tehlikeleri
NH3, uygun şekilde kullanılmadığı takdirde insan sağlığına ve çevreye ciddi şekilde zarar verebilecek oldukça zehirli ve aşındırıcı bir gazdır. NH3 gözlerde, ciltte ve solunum yollarında ciddi yanıklara neden olabilir ve ayrıca yüksek konsantrasyonlarda solunması halinde ölümcül olabilir. Ayrıca NH3 çok reaktiftir ve belirli kimyasallar veya malzemelerle temasa geçtiğinde tutuşabilir veya patlayabilir.
NH3’ü kullanırken veya onunla çalışırken güvenlik önlemlerinin alınması önemlidir. Buna eldiven, gözlük ve yüz maskesi gibi koruyucu giysiler giymenin yanı sıra gazın solunmasını önlemek için yeterli havalandırmanın sağlanması da dahildir. NH3’ün iyi havalandırılan alanlarda, ısı kaynaklarından ve diğer yanıcı malzemelerden uzakta depolanması da önemlidir. NH3’e maruz kalınması halinde, kirlenmiş giysilerin çıkarılması ve etkilenen bölgenin bol su ile durulanması önemlidir. Maruz kalma belirtileri ortaya çıkarsa derhal tıbbi yardım alın.
| Tehlike sembolleri | T+, N |
| Güvenlik Açıklaması | Çevre için tehlikeli, solunduğunda zararlı, tahriş edici |
| BİR tanımlayıcılar | BM 1005 |
| HS kodu | 2814.1 |
| Tehlike sınıfı | 2.3 |
| Paketleme grubu | II |
| Toksisite | Son derece toksik ve ölümcül doz (soluma) – 33-66 ppm |
Amonyak sentez yöntemleri
Amonyak sentezlemek için Haber süreci, Ostwald süreci ve Birkeland-Eyde süreci dahil olmak üzere çeşitli yöntemler vardır.
Haber-Bosch süreci olarak da bilinen Haber süreci, amonyağın endüstriyel sentezi için en yaygın kullanılan yöntemdir. Bu işlemde havadaki nitrojen gazı, demir katalizörü üzerinde hidrojen gazıyla reaksiyona girerek amonyak oluşturur. Reaksiyon yüksek basınç altında (yaklaşık 150 atmosfer) ve 450-500°C sıcaklıkta gerçekleşir. Haber süreci çok verimlidir; yüksek verimle büyük miktarlarda amonyak üretir ve gübre ve diğer kimyasalların üretiminde birincil amonyak kaynağı olarak kullanılır.
Nitrojen fiksasyonu işlemi olarak da bilinen Ostwald işlemi, nitrojen gazının nitrik okside oksidasyonunu ve ardından nitrik oksidin daha fazla nitrojen gazı ile reaksiyona girerek amonyak oluşturmasını içeren eski bir amonyak sentezi yöntemidir. Bu süreç daha az verimlidir ve yerini büyük ölçüde Haber süreci almıştır.
Plazma işlemi olarak da bilinen Birkeland-Eyde işlemi, nitrojen ve hidrojen gazlarını ayrıştırmak ve amonyak oluşturmak için plazma deşarjını kullanan daha yeni bir amonyak sentezi yöntemidir. Bu süreç hala geliştirme aşamasındadır ve endüstriyel kullanım için geniş çapta benimsenmemiştir.
Özetle, Haber süreci amonyak sentezi için en yaygın kullanılan yöntem iken Ostwald süreci ve Birkeland-Eyde süreci daha eski veya daha az yaygın olarak kullanılan yöntemlerdir.
Amonyağın Kullanım Alanları
Amonyak, endüstride ve tarımda geniş bir kullanım alanına sahip çok yönlü bir kimyasaldır. Amonyağın ana kullanımlarından bazıları şunlardır:
- Gübre Üretimi: Azotlu gübre üretiminin ana maddesi olan amonyak, ürün verimini artırır ve toprağın verimliliğini artırır.
- Soğutma: Endüstriyel ve evsel soğutma sistemleri, buzdolapları ve dondurucular da dahil olmak üzere soğutucu olarak amonyak kullanır.
- Temizlik: Ev temizlik ürünleri, yağ ve kiri çözme özelliğinden dolayı sıklıkla amonyak içerir.
- İlaçlar: Antiasitler ve öksürük şurupları gibi çeşitli farmasötik ürünlerin üretiminde hammadde olarak amonyak kullanılır.
- Tekstil üretimi: Tekstil boyama ve baskının yanı sıra sentetik elyaf üretiminde de amonyak kullanılır.
- Atık arıtma: Atık su arıtma tesislerinden gelen atık su arıtma ve koku kontrolü, amonyak kullanımını içerir.
- Alev Geciktiriciler: Amonyak, plastik, kauçuk ve diğerleri gibi malzemelerin üretiminde alev geciktirici görevi görür.
- Petrol ve gaz üretimi: Petrol ve gaz endüstrisi, yüzey aktif maddeler ve emülsifiye edici maddeler de dahil olmak üzere çeşitli kimyasallar üretmek için amonyak kullanır.
Sonuç olarak amonyak, tarım, soğutma, temizlik, ilaç, tekstil üretimi, atık arıtma, alev geciktiriciler ve petrol ve gaz üretimi dahil olmak üzere çeşitli endüstrilerde ve uygulamalarda geniş bir kullanım alanına sahip çok yönlü bir kimyasaldır.
Sorular:
Amonyak asit mi baz mı?
Amonyak bir baz olarak kabul edilir. Sulu çözeltilerde hidroksit iyonları (OH-) oluşturacak şekilde çözünür ve zayıf bir baz görevi görür. Amonyağın bazik (alkali) pH’ı genellikle 11 civarındadır. Amonyak çözeltileri, bir bazın tanımlayıcı özelliklerinden biri olan tuz ve su oluşturacak şekilde asitleri nötralize edebilir. Kimyasal reaksiyonlarda amonyak aynı zamanda bir nükleofil görevi görebilir ve amonyak türevleri olan ve aminlerin ve amidlerin nitrojen-karbon bağı özelliğini içeren amidleri oluşturan reaksiyonlara katılabilir.
Amonyak polar mıdır?
Evet amonyak polardır. Merkezi bir nitrojen atomunun üç hidrojen atomu ile çevrelendiği kavisli bir moleküler geometriye sahiptir. Bu şekil, dipolün pozitif ucunun hidrojen atomlarında ve negatif ucunun nitrojen atomunda bulunduğu kalıcı bir dipol momenti yaratır. Amonyağın polar yapısı, polar moleküllerin bir özelliği olan su gibi polar çözücüler içinde çözünmesine izin verir. Amonyağın polar yapısı aynı zamanda polar moleküller arasında meydana gelen bir tür moleküller arası kuvvet olan hidrojen bağına katılmasına da izin verir. Bu hidrojen bağı, benzer büyüklükteki polar olmayan moleküllere göre daha yüksek kaynama ve erime noktalarına yol açabilir.
