1-pentanol, beş karbon atomuna sahip, renksiz bir sıvı alkoldür. Kimyasal sentezlerde çözücü ve ara madde olarak kullanılır ve çeşitli endüstriyel uygulamalara sahiptir.
| IUPAC Adı | Pentan-1-ol |
| Moleküler formül | C₅H₁₁OH |
| CAS numarası | 71-41-0 |
| Eş anlamlı | Amil alkol, n-amil alkol, 1-hidroksipentan, n-pentil alkol, pentanol, pentil alkol |
| InChI | InChI=1S/C5H12O/c1-2-3-4-5-6/h6H,2-5H2,1H3 |
1-pentanolün özellikleri
Formül 1-pentanol
Pentanolün formülü C₅H₁₁OH’dur. Beş karbon atomu, on bir hidrojen atomu ve bir hidroksil grubundan (-OH) oluşur. Formül, bir pentanol molekülündeki spesifik düzenlemeyi ve atom türlerini temsil eder.
1-Pentanol Molar Kütle
Pentanolün molar kütlesi, onu oluşturan atomların atomik kütleleri toplanarak hesaplanır. Pentanolün molar kütlesi mol başına yaklaşık 88.15 gramdır (g/mol). Bir mol pentanol molekülünün kütlesi hakkında bilgi sağlar.
1-pentanolün kaynama noktası
Pentanolün kaynama noktası yaklaşık 138 santigrat derecedir (280 derece Fahrenheit). Bu sıcaklıkta sıvı pentanol gaz haline dönüşür. Kaynama noktası bir maddenin sıvı halden gaz haline geçtiği sıcaklığı gösterir.
1-Pentanol Erime Noktası
Pentanolün erime noktası yaklaşık -79 santigrat derecedir (-110 Fahrenheit derece). Bu, katı pentanolün sıvı formuna dönüştüğü sıcaklıktır. Erime noktası katı durumdan sıvı duruma geçişi temsil eder.
1-pentanol g/mL yoğunluğu
Pentanolün yoğunluğu mililitre başına yaklaşık 0,81 gramdır (g/mL). Yoğunluk birim hacim başına kütlenin ölçüsüdür. Bu, bir maddenin moleküllerinin ne kadar sıkı paketlendiğini gösterir.
1-Pentanol Molekül Ağırlığı
1-pentanolün moleküler ağırlığı mol başına yaklaşık 88.15 gramdır (g/mol). Bir moleküldeki tüm atomların atom ağırlıklarının toplamıdır. Molekül ağırlığı, bir maddenin mol sayısını veya kütlesini belirlemek gibi çeşitli hesaplamalarda kullanılır.
1-pentanolün yapısı
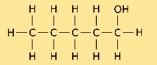
Pentanolün yapısı, bir ucuna bir hidroksil grubunun (-OH) bağlı olduğu, beş karbon atomundan oluşan düz bir zincirden oluşur. CH₃(CH₂)₃CH₂OH kimyasal formülüne sahiptir. Pentanolün yapısı, fiziksel ve kimyasal özelliklerinin belirlenmesinde çok önemli bir rol oynar.
1-pentanolün çözünürlüğü
Pentanol, eter ve aseton gibi organik çözücülerde çözünür, ancak suda sınırlı bir çözünürlüğe sahiptir. Hidroksil grubunun varlığı nedeniyle su molekülleri ile hidrojen bağları oluşturur. Pentanolün çözünürlüğü farklı ortamlardaki davranışını etkiler.
| Dış görünüş | Renksiz sıvı |
| Spesifik yer çekimi | 0,809-0,814 g/mL |
| Renk | Renksiz |
| Koku | Karakteristik koku |
| Molar kütle | 88,15 gr/mol |
| Yoğunluk | 0.81g/ml |
| Füzyon noktası | -79°C (-110°F) |
| Kaynama noktası | 138°C (280°F) |
| Flaş noktası | 54°C (129°F) |
| sudaki çözünürlük | Az çözünür |
| çözünürlük | Eter ve aseton gibi organik çözücülerde çözünür |
| Buhar basıncı | 2,5 mmHg (25°C) |
| Buhar yoğunluğu | 3,0 (hava = 1) |
| pKa | 16.2 |
| pH | 6.5-8.5 |
1-Pentanol Güvenliği ve tehlikeleri
Pentanol belirli güvenlik ve tehlike hususlarını ortaya çıkarmaktadır. Parlama noktası 54°c (129°f) olan yanıcı yapısı nedeniyle dikkatli kullanılmalıdır. Açık alev veya tutuşturucu kaynaklarla temastan kaçının. Pentanol buharlarının solunması solunum sisteminde tahrişe neden olabilir. Ciltle doğrudan temas, cildin tahriş olmasına veya kurumasına neden olabilir. Yanlışlıkla yutulursa gastrointestinal rahatsızlığa neden olabilir. Buharlara maruz kalmayı en aza indirmek için pentanol ile çalışırken yeterli havalandırma sağlanmalıdır. Güvenli kullanımı sağlamak için eldiven ve koruyucu gözlük gibi kişisel koruyucu ekipmanlar kullanılmalıdır. Pentanol ile çalışırken güvenlik veri sayfasını gözden geçirmek ve uygun güvenlik protokollerini takip etmek önemlidir.
| Tehlike sembolleri | Yanıcı (F) |
| Güvenlik Açıklaması | Isıdan/kıvılcımdan/açık alevden/sıcak yüzeylerden uzak tutun. Patlamaya dayanıklı elektrik/havalandırma/aydınlatma ekipmanı kullanın. Buharları solumaktan kaçının. Koruyucu eldiven/göz koruması/yüz koruması kullanın. |
| BM kimlik numaraları | BM 1105 |
| HS kodu | 2905.16.00 |
| Tehlike sınıfı | Sınıf 3 (Yanıcı sıvılar) |
| Paketleme grubu | GE II |
| Toksisite | Tahrişe neden olabilir. |
1-pentanol sentezi için yöntemler
Çeşitli yöntemler pentanol sentezine izin verir.
Yaygın bir yöntem, 1- bütenin bir rodyum katalizörü varlığında karbon monoksit ve hidrojen ile reaksiyonunu içeren 1 -büten hidroformilasyonudur. Bu işlem, bir aldehit ara ürünü karışımının oluşmasına ve ardından pentanol üretmek için hidrojenasyona yol açar.
Başka bir yöntem, sodyum borohidrit gibi bir indirgeyici madde kullanılarak bir aldehit bileşiği olan pentanalin indirgenmesini içerir. Bu indirgeme reaksiyonu pentanal’ı pentanole dönüştürür.
Kimyacılar pentanol üretmek için bir alken olan 1-penteni hidratlayabilirler. Bu reaksiyon, 1-pentenin karbon-karbon çift bağına su eklenmesini içerir ve pentanol oluşumuyla sonuçlanır.
Ek olarak pentanol, bir karboksilik asit olan pentanoik asidin hidrojenlenmesiyle sentezlenebilir. Reaksiyon, karbon üzerinde paladyum ve hidrojen gazı gibi uygun bir katalizörün varlığında gerçekleşir ve pentanoik asidin pentanole dönüşümüne yol açar.
Bu sentez yöntemleri, pentanol elde etmek için farklı yollar sunarak, mevcut hammaddelere ve istenen reaksiyon koşullarına bağlı olarak üretim esnekliği sağlar.
1-pentanolün kullanım alanları
Pentanol, özellikleri ve çok yönlülüğü nedeniyle farklı endüstrilerde çeşitli kullanımlara sahiptir. İşte dikkate değer uygulamalarından bazıları:
- Çözücü: Pentanol, ilaç, kaplama ve kozmetik gibi endüstrilerde birçok organik bileşiği etkili bir şekilde çözen bir çözücü olarak hizmet eder. Boya, vernik ve kişisel bakım ürünlerinin formülasyonunda çok önemli bir rol oynar.
- Kimyasal Sentez: Çeşitli kimyasalların sentezinde önemli bir ara madde olarak görev yapar. Parfüm, aroma ve farmasötik bileşenlerin üretiminde uygulama alanı bulan esterler, eterler ve diğer türevleri üretmek için reaksiyonlara girebilir.
- Ekstraksiyon: Ekstraksiyon işlemlerinde pentanol, belirli bileşikleri doğal ürünlerden ayırmak için kullanılır. Bitki materyallerinden değerli maddelerin çıkarılmasına yardımcı olarak uçucu yağların, parfümlerin ve aromaların üretimine katkıda bulunur.
- Temizlik maddesi: Elektronik, optik ve hassas imalat gibi endüstriler, yağları, gresleri ve diğer kirletici maddeleri çözme kabiliyeti nedeniyle pentanol’ü temizlik maddesi olarak kullanır. Yüzeylerdeki kalıntıları gidererek derinlemesine temizlik sağlar.
- Yakıt katkı maddesi: Bazı durumlarda pentanol, yanma verimliliğini artırmak ve emisyonları azaltmak için yakıt katkı maddesi olarak kullanılır. Benzin veya diğer yakıtlarla karıştırıldığında yakıtların performansını ve çevresel etkisini artırır.
- Endüstriyel Uygulamalar: Pentanol, boya sıyırma, metal yağdan arındırma ve endüstriyel temizlik dahil olmak üzere çeşitli endüstriyel işlemlerde kullanılır. Özellikleri, kaplamaların ve kirletici maddelerin yüzeylerden çıkarılmasında etkili olmasını sağlar.
- Araştırma ve Laboratuvar: Pentanol, bilimsel araştırma ve laboratuvarlarda reaktif veya çözücü olarak kullanılır. Çeşitli deneysel prosedürlerde reaksiyonları, ekstraksiyonları ve saflaştırmaları kolaylaştırır.
Pentanol’ün çeşitli uygulamaları, benzersiz özelliklerinin çok sayıda ürün ve prosesin geliştirilmesine katkıda bulunduğu çeşitli endüstrilerdeki önemini vurgulamaktadır.
Sorular:
Soru: Aşağıdakilerden hangisi suda daha fazla çözünür: asetik asit, pentanol, bütanoik asit veya pentanal?
Cevap: Asetik asit, verilen bileşikler arasında suda en çok çözünendir.
S: Pentanol suda çözünür mü?
C: Pentanolün suda çözünürlüğü sınırlıdır.
S: 4-metil-2-pentanolün dehidrasyonunu desteklemede asit katalizörünün işlevi nedir?
C: Asit katalizörü, bir su molekülünün 4-metil-2-pentanolden çıkarılmasını kolaylaştırarak dehidrasyonunu teşvik eder.
Soru: Sülfürik asit, asetik asit ve 1-pentanolün reaksiyonundan hangi ürün elde edilir?
C: Sülfürik asit, asetik asit ve pentanol arasındaki reaksiyon, ester bileşiklerinin oluşumuyla sonuçlanır.
S: Pentanolün hidrojen bağı var mı?
C: Evet, pentanol, hidroksil grubunun varlığı nedeniyle hidrojen bağı sergileyebilir.
S: 1-pentanolden pentanoik asit nasıl hazırlanır?
A: Pentanoik asit, uygun oksitleyici maddeler kullanılarak 1-pentanolün oksitlenmesiyle veya karşılık gelen esterinin hidrolize edilmesiyle elde edilebilir.
S: 1-pentanolün CrO3, H2O ve H2SO4 ile reaksiyonundan hangi organik ürünü elde edersiniz?
A: 1-pentanolün CrO3, H2O ve H2SO4 ile reaksiyonu, karşılık gelen karboksilik asidin oluşumuna yol açar.
S: Suda hangisi daha az çözünür, 1-pentanol veya 1-heptanol? Açıklamak.
C: Pentanol, daha kısa hidrokarbon zinciri nedeniyle suda 1-heptanolden daha az çözünür, bu da su molekülleriyle daha zayıf etkileşimlere neden olur.
S: 1-pentanolün PBr3 ile reaksiyonundan hangi organik ürünü elde edersiniz?
C: Pentanolün PBr3 ile reaksiyonu hidroksil grubunun ikamesine yol açarak 1-bromopentan oluşumuna yol açar.
