Etan, C2H6 kimyasal formülüne sahip bir hidrokarbondur. Yaygın olarak yakıt olarak kullanılır ve doğal gazın bir bileşenidir. Etan iki karbon atomuna ve altı hidrojen atomuna sahiptir.
| IUPAC Adı | Etan |
| Moleküler formül | C2H6 |
| CAS numarası | 74-84-0 |
| Eş anlamlı | Dietil, dimetil, etil hidrit, metilmetan |
| InChI | InChI=1S/C2H6/c1-2/h1-2H3 |
Etanın özellikleri
Etan formülü
Etanın kimyasal formülü C2H6’dır. Bu, her etan molekülünün iki karbon atomu ve altı hidrojen atomundan oluştuğunu gösterir. Formül etanın bileşimini ve yapısal düzenini anlamamıza yardımcı olur.
Etan Molar Kütlesi
Etil hidrürün molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanır. Karbonun atom kütlesi 12,01 g/mol ve hidrojenin atom kütlesi 1,008 g/mol’dür. Atomik kütlelerin ilgili sayılarla çarpılması ve eklenmesi, yaklaşık 30.07 g/mol olan etil hidrürün molar kütlesini verir.
Etanın kaynama noktası
Etil hidrürün kaynama noktası -88,6 santigrat derecedir. Bu, standart atmosferik basınçta, etil hidrürün bu sıcaklığa ısıtıldığında sıvıdan gaza dönüşeceği anlamına gelir. Kaynama noktası önemli bir özelliktir çünkü etil hidrürün buharlaşabileceği koşulları belirler.
Etan Erime Noktası
Etil hidrürün erime noktası -182,8 santigrat derecedir. Bu noktanın altındaki sıcaklıklarda etil hidrit katı halde bulunur. Bu sıcaklığa veya daha yüksek bir sıcaklığa ısıtıldığında etil hidrit, katı halden sıvı duruma bir faz değişimine uğrar. Erime noktası, soğutma veya ısıtma işlemleri sırasında etil hidrürün fiziksel davranışını anlamak için çok önemlidir.
Etan yoğunluğu g/mL
Etil hidrürün yoğunluğu, standart sıcaklık ve basınçta yaklaşık 0,55 g/mL’dir. Yoğunluk, belirli bir hacimde mevcut olan kütle miktarının bir ölçüsüdür. Etil hidrit söz konusu olduğunda, moleküllerinin ne kadar sıkı bir şekilde paketlendiğini bize söyler ve fiziksel özellikleri hakkında fikir verir.
Etan Molekül Ağırlığı
Etil hidrürün moleküler ağırlığı 30.07 g/mol’dür. Tek bir etil hidrit molekülündeki tüm atomların atomik kütlelerinin toplamıdır. Molekül ağırlığı, belirli bir kütle veya hacimde ne kadar etil hidrit bulunduğunu belirlememize yardımcı olur.
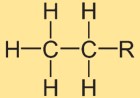
Etanın yapısı
Etil hidrürün yapısı, tek bir kovalent bağ ile birbirine bağlanan iki karbon atomundan oluşur. Her karbon atomu üç hidrojen atomu ile çevrilidir. Yapısal düzenleme doğrusaldır ve hidrojen atomları karbon-karbon bağı etrafında simetrik olarak konumlandırılmıştır.
Etanın çözünürlüğü
Etil hidrit suda çok çözünmez. Polar olmayan bir moleküldür, su ise polar bir çözücüdür. Etil hidrit gibi polar olmayan moleküller zayıf moleküller arası kuvvetlere sahiptir ve polar çözücülerde kolayca çözünmezler. Bununla birlikte etil hidrit, heksan veya benzen gibi diğer polar olmayan çözücüler içinde çözülebilir.
| Dış görünüş | Renksiz gaz |
| Spesifik yer çekimi | 1,038 gr/L |
| Renk | Yok |
| Koku | Kokusuz |
| Molar kütle | 30,07 g/mol |
| Yoğunluk | 0.55g/ml |
| Füzyon noktası | -182,8°C |
| Kaynama noktası | -88,6°C |
| Flaş noktası | -135°C |
| sudaki çözünürlük | Çözünmez |
| çözünürlük | Polar olmayan solventlerde çözünür |
| Buhar basıncı | 46,9 psi (21°C’de) |
| Buhar yoğunluğu | 1,52 (hava = 1) |
| pKa | ~50 |
| pH | Yok |
Etan Güvenliği ve Tehlikeleri
Etil hidrit çeşitli güvenlik hususları ve tehlikeler sunar. Oldukça yanıcıdır ve havayla patlayıcı karışımlar oluşturabilir. Bir aleve veya ısı kaynağına maruz kaldığında etil hidrit tutuşarak yangına veya patlamaya neden olabilir. Etil hidrürün iyi havalandırılmış alanlarda, tutuşma kaynaklarından uzakta kullanılması ve saklanması önemlidir. Etil hidrit aynı zamanda kapalı alanlardaki oksijenin yerini aldığı için boğulma tehlikesi de oluşturur. Yüksek konsantrasyonda etil hidrürün solunması baş dönmesine, mide bulantısına ve hatta bilinç kaybına neden olabilir. Bu riskleri azaltmak için etil hidritle veya yakınında çalışırken uygun kişisel koruyucu ekipmanın kullanılması ve güvenlik protokollerinin takip edilmesi önemlidir.
| Tehlike sembolleri | Yanıcı gaz |
| Güvenlik Açıklaması | Isıdan, kıvılcımlardan ve açık alevden uzak tutun. İyi havalandırılmış alanlarda kullanın. Yangın veya patlama riskini önlemek için uygun önlemleri alarak kullanın. |
| BM kimlik numaraları | UN1035 |
| HS kodu | 29011000 |
| Tehlike sınıfı | 2.1 (Yanıcı gaz) |
| Paketleme grubu | Uygulanamaz |
| Toksisite | Etan çok zehirli sayılmaz. Ancak yüksek konsantrasyonların solunması boğulmaya neden olabilir. Yeterli havalandırma ile kullanın ve uzun süreli maruziyetten kaçının. |
Etan sentezi yöntemleri
Etil hidrit çeşitli yöntemlerle sentezlenir.
Yaygın bir yöntem, yüksek sıcaklıkların (yaklaşık 750 ila 900 °C) hidrokarbonları, genellikle etil hidrit veya daha ağır hidrokarbonları, buhar varlığında ısıttığı buharla kırma işlemidir. Bu işlem, etil hidrit, etilen ve propilen üreten termal ayrışma ve yeniden düzenleme dahil olmak üzere reaksiyonları tetikler.
Başka bir yöntem, asetilen gazının hidrojen ile paladyum veya nikel gibi uygun katalizörler üzerinde reaksiyona girerek etil hidrit ürettiği asetilenin katalitik hidrojenasyonunu içerir. Bu yöntem, yüksek düzeyde reaktif ve potansiyel olarak tehlikeli asetileni seçici olarak daha kararlı ve daha az reaktif bir etil hidrüre dönüştürür.
Etan ayrıca doğal gazdan kriyojenik ekstraksiyon yoluyla da elde edilebilir. Doğal gaz, özellikle metil hidrit, etil hidrürün ayrılması ve geri kazanılması için düşük sıcaklıklara ve yüksek basınçlara tabi tutulur. Doğal gaz işleme tesisleri, çeşitli endüstriyel uygulamalar için değerli etil hidrürün çıkarılması amacıyla yaygın olarak bu işlemi kullanır.
Ek olarak, petrol rafinerisi ve bazı petrokimyasal işlemler, yan ürün olarak etil hidrit üretir. Damıtma veya absorpsiyon gibi teknikler, etil hidrürü diğer hidrokarbon akımlarından ayırır.
Genel olarak bu sentez yöntemleri, dünya çapında birçok endüstriye katkıda bulunan, çok çeşitli kimyasalların, plastiklerin ve yakıtların üretimi için önemli bir hammadde olan etil hidritin üretimini mümkün kılar.
Etanın kullanım alanları
Etil hidrit, çok yönlü özelliklerinden dolayı çeşitli endüstrilerde uygulama alanı bulur. Etil hidrürün bazı önemli kullanım alanları şunlardır:
- Petrokimya endüstrisi: Etil hidrit, plastiklerin, reçinelerin ve sentetik elyafların temelini oluşturan etilen üretimi için önemli bir hammaddedir. Dünyada en çok kullanılan plastiklerden biri olan polietilenin üretiminde önemli bir unsurdur.
- Yakıt ve Enerji: Etil hidrit, belirli endüstriyel süreçlerin yakıt ve enerjilendirilmesinde rol oynar ve doğal gazın bir bileşenidir. Endüstriler, konut, ticari ve endüstriyel uygulamalar için enerji kaynağı olarak hizmet veren ısı veya elektrik üretmek için etil hidriti yakıyor.
- Soğutma: Düşük sıcaklık sistemleri gibi bazı uygulamalarda etil hidrit, soğutucu görevi görerek verimli soğutma özellikleri sağlar. Verimli soğutma yetenekleri sunar ve çevresel etkisi daha yüksek olan diğer soğutucu akışkanlara bir alternatiftir.
- Çözücü: Etil hidrit, özellikle laboratuvarda polar olmayan bir çözücü görevi görür. Etil hidrit ekstraksiyon, saflaştırma ve analiz gibi işlemleri kolaylaştırır.
- Kalibrasyon gazı: Etil hidrit, gaz dedektörleri ve analizörleri için gaz karışımlarının kalibrasyonunda bir bileşen olarak görev yapar ve gaz algılama ekipmanının kalibrasyonunu ve doğrulanmasını sağlar.
- Aerosol İtici Madde: Etil hidrit, çeşitli ürünlerde bir aerosol itici madde olarak işlev görür ve basıncın serbest bırakılması üzerine içeriklerini kaptan dışarı atar. Kozmetik, boya ve ev ürünleri gibi maddeleri püskürtmek için gereken kuvveti verir.
- Kimyasal sentez: Etil hidrit, etanol, etilen oksit ve vinil klorür dahil olmak üzere çeşitli organik kimyasalların sentezi için hammadde görevi görür. Bu kimyasallar diğerlerinin yanı sıra solventler, plastikler, deterjanlar ve PVC boruların üretiminde uygulama alanı bulmaktadır.
Bu çeşitli uygulamalar, etil hidrürün birçok endüstrideki önemini vurgulayarak onu modern üretimde ve günlük yaşamda çok önemli bir unsur haline getiriyor.
Sorular:
S: C2H6 polar mı yoksa polar değil mi?
C: C2H6 (etil hidrit) polar olmayan bir moleküldür çünkü karbon ve hidrojen arasındaki elektronegatiflik farkı küçüktür, bu da elektron yoğunluğunun düzgün bir dağılımına neden olur.
Soru: 0,500 mol C2H6’da kaç mol karbon atomu vardır?
C: 0,500 mol C2H6’da 1,00 mol karbon atomu vardır, çünkü her C2H6 molekülü 2 karbon atomu içerir.
S: C2H6’nın ampirik formülü nedir?
C: C2H6’nın deneysel formülü, molekülde bulunan atomların en basit oranını temsil eden CH3’tür.
S: C2H6 nedir?
C: C2H6, yaygın olarak yakıt ve doğal gaz bileşeni olarak kullanılan gaz halindeki bir hidrokarbon olan etil hidrürün kimyasal formülüdür.
S: Etanın (C2H6) neden yapısal izomeri yok?
C: Etil hidrürün (C2H6) yapısal izomeri yoktur çünkü karbon atomları tek bir bağla birleştirilir, bu da başka hiçbir olası düzenlemenin olmadığı doğrusal bir yapıyla sonuçlanır.
S: C2H6’da hidrojen bağı var mı?
C: C2H6 (etil hidrit), nitrojen, oksijen veya flor gibi yüksek derecede elektronegatif elementlere bağlı hidrojen atomlarından yoksun olduğundan hidrojen bağına sahip değildir.
S: C2H6 iyonik mi yoksa kovalent mi?
C: C2H6 kovalent bir bileşiktir çünkü karbon ve hidrojen atomları arasında elektronların paylaşılmasıyla oluşur.
S: C2H6 suda çözünür mü?
C: C2H6 suda çözünmez çünkü polar olmayan bir moleküldür ve polar çözücüde kolayca çözünmez.
S: Bir gaz karışımı eşmolar oranda CH4 ve C2H6 içeriyor mu?
C: Evet, eğer gaz karışımı eş molar oranda CH4 ve C2H6 içeriyorsa, bu, CH4’ün mol sayısının karışımdaki C2H6’nın mol sayısına eşit olduğu anlamına gelir.
