Baryum nitrat (Ba(NO3)2) beyaz bir katıdır. Suda çözünür ve baryum ve nitrat iyonları oluşturur. Isıtıldığında veya yakıtlarla karıştırıldığında patlayabilir.
| IUPAC’ın adı | Baryum dinitrat |
| Moleküler formül | Ba(NO3)2 |
| CAS numarası | 10022-31-8 |
| Eş anlamlı | Baryum nitrat, Baryumdinitrat, Baryum dinitrat, CQ9625000, (nitrooksi)bariyo nitrat |
| InChI | InChI=1S/Ba.2NO3/c;2 2-1(3)4/q+2;2 -1 |
Baryum nitratın özellikleri
Baryum Nitrat Formülü
Baryum nitratın moleküler formülü Ba(NO3)2’dir. Bir baryum nitrat molekülünün bir baryum atomu ve iki nitrat molekülünden oluştuğunu gösterir. Nitrat iyonunun yükü -1 ve baryum iyonunun yükü +2’dir, dolayısıyla nötr bir bileşik oluşturmak üzere 1:2 oranında birleşirler.
Baryum Nitrat Molar Kütlesi
Ba(NO3)2’nin molar kütlesi 261.337 g/mol’dür. Bir mol Ba(NO3)2 molekülünün kütlesidir. Bunu hesaplamak için formüldeki tüm atomların atom kütlelerini eklemeniz gerekir:
Ba(NO3)2’nin molar kütlesi = (1 x 137,327) + (2 x 14,007) + (6 x 15,999) = 261,337 g/mol
Baryum nitratın kaynama noktası
Ba(NO3)2’nin kaynama noktası 83°C’dir. Ba(NO3)2’nin sıvı halden gaz haline geçtiği sıcaklıktır. Ancak Ba(NO3)2 kaynama noktasına ulaşamadan ayrıştığı için başka maddelere parçalanmadan kaynatılması mümkün değildir.
Baryum nitrat Erime noktası
Ba(NO3)2’nin erime noktası 592°C’dir. Ba(NO3)2’nin katı halden sıvı hale geçtiği sıcaklıktır. Ba(NO3)2, oda sıcaklığında ve basınçta beyaz kristalli bir katıdır, ancak erime noktasının üzerine ısıtıldığında erir.
Baryum nitratın yoğunluğu g/ml
Ba(NO3)2’nin yoğunluğu 3,23 g/ml’dir. Bu, Ba(NO3)2’nin birim hacmi başına kütlesidir. Bunu hesaplamak için Ba(NO3)2 örneğinin kütlesini hacmine bölmeniz gerekir:
Ba(NO3)2 Yoğunluğu = Kütle / Hacim
Örneğin, 10 g Ba(NO3)2 numunemiz varsa ve hacmi 3,1 ml ise yoğunluğu:
Ba(NO3)2 Yoğunluğu = 10 / 3,1 = 3,23 g/ml
Baryum Nitrat Molekül Ağırlığı
Ba(NO3)2’nin moleküler ağırlığı, 261.337 g/mol olan molar kütlesiyle aynıdır. Bir mol Ba(NO3)2 molekülünün kütlesidir. Bazen moleküler ağırlık terimi molar kütle ile birbirinin yerine kullanılır, ancak bunlar tam olarak aynı değildir. Molekül ağırlığı, bir maddenin bir molekülünün ortalama kütlesini belirtirken, molar kütle, bir maddenin bir molünün kütlesini belirtir.
Baryum nitratın yapısı
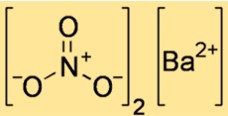
Ba(NO3)2’nin yapısı atomların ve iyonların uzayda nasıl dizildiklerini gösterir. Ba(NO3)2 iyonik bir bileşiktir, yani elektrostatik kuvvetler tarafından bir arada tutulan pozitif yüklü baryum iyonlarından ve negatif yüklü nitrat iyonlarından oluşur. Ba(NO3)2’nin yapısı, bir kristal kafes içindeki iyonların düzenini gösteren en küçük tekrar eden birim olan bir birim hücre ile temsil edilebilir.
Ba(NO3)2 birim hücresi kübik bir şekle sahiptir; her köşesinde bir baryum iyonu ve her yüzünün merkezinde bir nitrat iyonu bulunur. Her iyonun koordinasyon sayısı altıdır; bu, her iyonun altı zıt yüklü iyonla çevrelendiği anlamına gelir. Birim hücrenin her bir kenarının uzunluğu 0,65 nm’dir.
Baryum nitratın çözünürlüğü
Ba(NO3)2 çözünürlüğü, belirli bir miktarda çözücü, genellikle su içinde çözünebilen Ba(NO3)2 miktarıdır. Çözünürlük sıcaklık, basınç ve çözeltideki diğer maddelerin varlığı gibi çeşitli faktörlere bağlıdır.
20°C’de ve atmosferik basınçta Ba(NO3)2’nin sudaki çözünürlüğü 100 ml başına yaklaşık 34 g’dır. Bu, bu koşullar altında 34 g Ba(NO3)2’nin 100 ml suda çözünebileceği anlamına gelir. Çözünürlük sıcaklık arttıkça artar, basınç arttıkça azalır.
Ba(NO3)2 ayrıca etanol, aseton ve metanol gibi diğer çözücülerde de çözünür, ancak suya göre daha az çözünür.
| Dış görünüş | Beyaz katı |
| Spesifik yoğunluk | 3.23 |
| Renk | Renksiz, gümüş veya gri |
| Koku | Kokusuz |
| Molar kütle | 261.337 gr/mol |
| Yoğunluk | 3.23g/ml |
| Füzyon noktası | 592°C |
| Kaynama noktası | 83°C |
| Flaş noktası | Yanıcı değil |
| sudaki çözünürlük | 20°C’de 100 ml başına 34 g |
| çözünürlük | Etanol, aseton ve metanolde çözünür; eter ve kloroformda çözünmez |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Müsait değil |
Baryum nitratın güvenliği ve tehlikeleri
Ba(NO3)2 toksik ve oksitleyici bir maddedir. Yutmanız veya solumanız halinde size zarar verebilir. Bu gözleri, cildi ve solunum sistemini tahriş edebilir. Ba(NO3)2 ayrıca kas spazmlarına, kalp sorunlarına ve ölüme de neden olabilir. Ba(NO3)2 ile temastan kaçınmalı ve kullanırken koruyucu ekipman kullanmalısınız. Ayrıca ısıdan, kıvılcımdan, alevden ve yanıcı maddelerden uzak tutmalısınız. Ba(NO3)2’ye maruz kalırsanız gözlerinizi ve cildinizi suyla yıkayıp tıbbi yardım almalısınız. Baryum toksisitesini azaltmak için sülfat tuzları da alabilirsiniz.
| Tehlike sembolleri | O (oksidan), Xn (zararlı) |
| Güvenlik Açıklaması | S13: Hayvanlara yönelik olanlar dahil yiyecek ve içeceklerden uzak tutun. S17: Yanıcı maddelerden uzak tutun. S22: Tozu solumayın. S26: Göz ile teması halinde derhal bol su ile yıkayın ve doktora başvurun. S36/37/39: Uygun koruyucu kıyafet, eldiven ve göz/yüz koruması kullanın. |
| BM kimlik numaraları | UN1446 |
| HS kodu | 2834 29 10 |
| Tehlike sınıfı | 5.1 (Oksitleyici malzemeler) |
| Paketleme grubu | III |
| Toksisite | LD50 (oral, sıçan) = 355 mg/kg; LC50 (soluma, sıçan) = 0,15 mg/L/4 saat |
Baryum nitratın sentezi için yöntemler
Beyaz katı bir madde olan Ba(NO3)2’yi oluşturmak için farklı yöntemler kullanılabilir.
Bir yöntem, baryum karbonatın nitrik asitle reaksiyona sokulmasını içerir. Bu Ba(NO3)2 ve karbondioksit üretir. Ba(NO3)2 çözeltisini filtreleyerek demir yabancı maddelerini giderin, ardından katı kristaller elde etmek için buharlaştırın.
Diğer bir yöntem ise baryum sülfürün nitrik asitle reaksiyona sokulmasıdır. Bu Ba(NO3)2 ve hidrojen sülfit üretir. Ba(NO3)2 çözeltisini saflaştırmak ve kristalleştirmek için önceki işlemin aynısını izliyoruz.
Üçüncü bir yöntem, baryum metalinin veya baryum oksidin nitrik asit içinde çözülmesini içerir. Bu Ba(NO3)2 ve hidrojen veya su üretir. Ba(NO3)2 içeren çözelti daha sonra konsantre edilir ve kristalleşmeye tabi tutulur.
Dördüncü yöntem ise erimiş tuz sentezinin kullanılmasıdır. Bu, Ba(NO3)2 ile amonyum klorür, sodyum bikarbonat veya sodyum nitrit gibi inorganik bir vesikant karışımının ısıtılmasını içerir. Vezikant parçalanır ve Ba(NO3)2 kristallerinde gözenekler oluşturur. Bu onları piroteknik oksitleyiciler olarak daha güvenilir kılar.
Ba(NO3)2 sentezleme yöntemlerinden bazıları şunlardır. Hepsi ortak reaktan olarak nitrik asit kullanır ve ürün olarak Ba(NO3)2 üretirler.
Baryum Nitrat Kullanım Alanları
Ba(NO3)2’nin bazı kullanım alanları şunlardır:
- Baryum Oksit Bileşikleri – Seramik, cam ve katot ışın tüpleri gibi baryum oksit içeren malzemelerin üretiminde kullanılır.
- Yeşil Alev – Baryum iyonlarının emisyonu nedeniyle yeşil alevle yandığı için yeşil trafik ışıklarında ve havai fişeklerde kullanılır.
- Rodentisit – Fareler ve fareler için toksik olduğundan onları öldürmek için kemirgen ilacı olarak kullanılır.
- Oksitleyici – Patlayıcılarda ve patlayıcılarda kullanılan bu madde, diğer maddelerin yanmasını artırabilen güçlü bir oksitleyicidir.
- Astar – Mühimmatın ateşlenmesini ve görünürlüğünü sağladığı için astarlarda ve izli mermilerde kullanılır.
- Pigment – Boya ve pigment yapımında kullanılır çünkü onlara beyaz veya yeşil bir renk verebilir.
- Oksitleyici Ajan – Baryum peroksit ve baryum hidroksitin sentezi gibi çeşitli kimyasal reaksiyonlarda oksitleyici ajan olarak kullanılır.
- Patlayıcılar – Ba(NO3)2, TNT ve bağlayıcının karışımı olan Baratol gibi patlayıcıların üretiminde kullanılır.
Sorular:
S: Baryum nitrat çözünür mü?
C: Ba(NO3)2 suda ve etanol, aseton ve metanol gibi diğer bazı çözücülerde çözünür.
S: Baryum nitrat beton için faydalı mıdır?
C: Ba(NO3)2 beton için kullanışlı değildir çünkü çelik donatıların korozyonuna ve betonun çatlamasına neden olabilir.
S: Potasyum sülfat ve baryum nitrat çözeltileri birleştirilirse çökelti oluşur mu?
C: Evet, potasyum sülfat (K2SO4) ve baryum nitrat (Ba(NO3)2) çözeltileri birleştirilirse bir baryum sülfat (BaSO4) çökeltisi oluşacaktır.
Soru: Baryum nitrat Ba(NO3)2 formülüne sahiptir. Baryum nitratla ilgili hangi ifade doğrudur?
C: Olası ifadelerden biri şudur: Ba(NO3)2, bir baryum iyonu ve iki nitrat iyonundan oluşan iyonik bir bileşiktir.
S: Baryum nitrat uçucu mudur?
C: Hayır, Ba(NO3)2 uçucu değildir çünkü erime noktası yüksektir ve kaynamadan önce ayrışır.
S: Baryum nitrat nötr mü?
C: Hayır, Ba(NO3)2 nötr değildir çünkü bir çözeltinin pH’ını düşürebilen asidik bir tuzdur.
Soru: Ba(NO3)2 ve Na2SO4’ün yer değiştirme reaksiyonunda ne üretilir?
A: Ba(NO3)2 ve Na2SO4’ün yer değiştirme reaksiyonu sırasında NaNO3 ve BaSO4 üretilir.
S: Ba(NO3)2 suda çözünür mü?
C: Evet, Ba(NO3)2 suda çözünerek baryum iyonları ve nitrat iyonları oluşturur.
S: MgSO4’ün Ba(NO3)2 ile reaksiyonunun net iyonik denklemi nedir?
A: MgSO4’ün Ba(NO3)2 ile reaksiyonunun net iyonik denklemi şöyledir:
Ba2+ + SO42- → BaSO4
Soru: 432 g Ba(NO3)2’de kaç mol vardır?
A: 432 g Ba(NO3)2’deki mol sayısı:
n = m/M, n = 432/261.337, n = 1.653 mol
S: Ba(NO3)2 çözünür mü?
C: Evet, Ba(NO3)2 çözünür çünkü baryum iyonları ve nitrat iyonları oluşturmak üzere çözünür.
