Amonyum sülfat ((NH4)2SO4), bitkilere gerekli besinleri sağlayan, yaygın olarak kullanılan bir gübredir. Ayrıca alev geciktiricilerde, protein saflaştırmasında ve gıda katkı maddesi olarak da kullanılır.
| IUPAC’ın adı | Amonyum tetraoksosülfat (VI) |
| Moleküler formül | (NH4)2SO4 |
| CAS numarası | 7783-20-2 |
| Eş anlamlı | Amonyum sülfat, amonyum sülfat (2:1), diamonyum sülfat, sülfürik asidin diamonyum tuzu, mascagnite, Actamaster, Dolamin |
| InChI | InChI=1S/2H3N.H2O4S/c;;1-5(2,3)4/h2*1H3;(H2,1,2,3,4) |
Amonyum sülfatın özellikleri
Amonyum sülfat formülü
Amonyum sülfatın formülü (NH4)2SO4’tür. Bu, bir amonyum sülfat molekülünün iki amonyum iyonu (NH4)+ ve bir sülfat iyonu (SO4)2- içerdiği anlamına gelir. Amonyum iyonları ve sülfat iyonu iyonik bağlarla bir arada tutulur.
Amonyum Sülfat Molar Kütlesi
(NH4)2SO4’ün molar kütlesi 132,14 g/mol’dür. Molar kütleyi hesaplamak için formüldeki tüm atomların atom kütlelerini toplamamız gerekir. Atom kütleleri:
- Azot: 14,01 g/mol
- Hidrojen: 1,01 g/mol
- Kükürt: 32,06 g/mol
- Oksijen: 16,00 g/mol
Dolayısıyla (NH4)2SO4’ün molar kütlesi:
(2 x 14,01) + (8 x 1,01) + 32,06 + (4 x 16,00) = 132,14 g/mol
Amonyum sülfatın kaynama noktası
(NH4)2SO4’ün kaynama noktası iyi tanımlanmamıştır çünkü kaynama noktasına ulaşmadan ayrışır. (NH4)2SO4, 235°C’nin üzerine ısıtıldığında su kaybetmeye ve amonyum bisülfat (NH4)HSO4 oluşturmaya başlar. Amonyum bisülfat, 280°C’nin üzerine ısıtıldığında ayrıca amonyak (NH3) ve sülfürik asit (H2SO4) halinde ayrışır.
Amonyum sülfat Erime noktası
(NH4)2SO4’ün erime noktası 235°C’dir. Bu, (NH4)2SO4’ün katı halden sıvı hale geçtiği sıcaklıktır. Ancak yukarıda da belirtildiği gibi (NH4)2SO4 de bu sıcaklıkta ayrışmaya başlar, yani saf sıvı faz değildir.
Amonyum sülfatın yoğunluğu g/ml
(NH4)2SO4’ün yoğunluğu oda sıcaklığında ve basınçta 1,77 g/ml’dir. Bu, bir mililitre (NH4)2SO4’ün 1,77 gram ağırlığında olduğu anlamına gelir. Bir maddenin yoğunluğu, sıcaklığına ve basıncına bağlıdır, dolayısıyla farklı koşullar altında biraz değişebilir.
Amonyum Sülfat Molekül Ağırlığı
(NH4)2SO4’ün moleküler ağırlığı, 132,14 g/mol olan molar kütlesiyle aynıdır. Molekül ağırlığı, bir maddenin bir molünün kütlesidir ve bu da 6.022 x 10^23 moleküle eşittir. Molekül ağırlığı aynı zamanda bir karbon-12 atomunun kütlesinin 1/12’sine eşit olan atomik kütle birimleri (amu) cinsinden de ifade edilebilir. Amu cinsinden (NH4)2SO4’ün moleküler ağırlığı 132,14 amu’dur.
Amonyum sülfatın yapısı
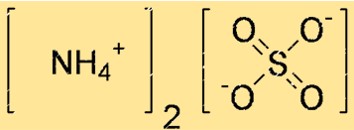
(NH4)2SO4’ün yapısı Lewis nokta yapısıyla veya top ve çubuk modeliyle temsil edilebilir. Lewis nokta yapısı, her atomun değerlik elektronlarını ve aralarındaki bağları gösterir. Top ve çubuk modeli, her atomun şeklini, boyutunu ve aralarındaki bağları gösterir.
Yukarıdaki yapıda çift çizgiler (=) çift bağları, tek çizgiler (-) tekli bağları ve noktalar (.) yalnız elektron çiftlerini temsil eder.
Amonyum sülfatın çözünürlüğü
(NH4)2SO4’ün çözünürlüğü, belirli bir sıcaklıkta, belirli miktarda suda çözünebilen (NH4)2SO4 miktarıdır. Aşağıdaki verilerde gösterildiği gibi (NH4)2SO4’ün çözünürlüğü sıcaklık arttıkça artar:
| Sıcaklık (°C) | Çözünürlük (g/100 ml su) |
| 0 | 70.6 |
| Dış görünüş | İnce beyaz higroskopik granüller veya kristaller |
| Spesifik yoğunluk | 1.77 |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 132,14 gr/mol |
| Yoğunluk | 1,77 gr/cm3 |
| Füzyon noktası | 235 ila 280°C (ayrışır) |
| Kaynama noktası | Uygulanamaz (ayrıştırılmış) |
| Flaş noktası | Yanıcı değil |
| sudaki çözünürlük | 100 g suya (0°C) 70,6 g, 100 g suya (20°C) 74,4 g, 100 g suya (100°C) 103,8 g |
| çözünürlük | Aseton, alkol ve eterde çözünmez |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 5,5 (amonyum iyonu için) |
| pH | 5 ila 6 (%5’lik çözelti için) |
Amonyum sülfatın güvenliği ve tehlikeleri
(NH4)2SO4 insan sağlığına çok zararlı değildir ancak temas etmesi veya solunması halinde ciltte, gözlerde, burunda ve boğazda tahrişe neden olabilir. Ayrıca yutulması halinde mide bulantısı, mide ağrısı, ishal, kusma ve uyuşukluğa neden olabilir. Sudaki yaşama zararlıdır ve çevreye salınmasından kaçınılmalıdır. 235°C’nin üzerine ısıtıldığında ayrışarak amonyak ve sülfürik asit gibi zehirli gazlar oluşturur. Genellikle bir gıda katkı maddesi olarak güvenli olduğu kabul edilir, ancak bazı kişilerde alerjik reaksiyonlara veya astım semptomlarına neden olabilir.
| Tehlike sembolleri | Gerekli değil |
| Güvenlik Açıklaması | Çevreye salınmasından kaçının. İçeriği/kabı onaylı bir atık imha tesisine atın. |
| BM kimlik numaraları | Uygulanamaz |
| HS kodu | 31022100 |
| Tehlike sınıfı | Uygulanamaz |
| Paketleme grubu | Uygulanamaz |
| Toksisite | LD50 (oral, sıçan) = 2,840 mg/kg |
Amonyum sülfat sentezi için yöntemler
(NH4)2SO4 inorganik bir tuz olduğundan çeşitli yöntemlerle sentezlenebilmektedir. Yaygın yöntemlerden bazıları şunlardır:
- Amonyak ve sülfürik asidin nötralizasyonu: Bu yöntem, amonyak gazının veya sulu bir çözeltinin sülfürik asitle karıştırılmasını ve suyun buharlaştırılarak (NH4)2SO4 kristallerinin elde edilmesini içerir.
2NH3 + H2SO4 -> (NH4)2SO4
- Amonyum karbonat ve alçı reaksiyonu: Bu yöntem, ince bölünmüş alçıtaşının ( kalsiyum sülfat ) bir amonyum karbonat çözeltisine eklenmesini ve kalsiyum karbonat çökeltisinin filtrelenmesini içerir.
(NH4)2CO3 + CaSO4 -> (NH4)2SO4 + CaCO3
- Diğer proseslerin yan ürünü: Kok fırını gazının saflaştırılması, kaprolaktam üretimi, nikel rafinasyonu ve baca gazı kükürtünün giderilmesi gibi çeşitli endüstriyel prosesler, yan ürün olarak (NH4)2SO4 üretebilir. Bu işlemlerde gaz akışlarından kükürt veya diğer yabancı maddeleri uzaklaştırmak için amonyak veya amonyum bileşikleri kullanılır ve sonuçta atık veya değerli bir ürün olarak (NH4)2SO4 ortaya çıkar.
Amonyum sülfatın kullanım alanları
(NH4)2SO4, aşağıdakiler gibi çeşitli kullanımlara sahip inorganik bir tuzdur:
- Alkali Toprak Gübresi: (NH4)2SO4 toprağın pH’ını düşürür ve bitki büyümesi için azot ve kükürt sağlar. Yaban mersini, patates ve domates gibi asitli toprak gerektiren ürünler için uygundur.
- Tarımsal sprey yardımcı maddesi: (NH4)2SO4, suda çözünebilen böcek öldürücülerin, herbisitlerin ve fungisitlerin etkilerini, bunların etkilerine müdahale edebilecek demir ve kalsiyum iyonlarını bağlayarak artırır. Aynı zamanda glifosatın ve diğer sistemik herbisitlerin bitkiler tarafından alımını da artırır.
- Protein saflaştırması: (NH4)2SO4, iyonik gücü artırarak ve protein çözünürlüğünü azaltarak proteinleri sulu çözeltilerden çökeltebilir. Tuzlama yöntemi, proteinleri boyutlarına, yüklerine ve hidrofobikliklerine göre ayırmak için kullanılabilir.
- Gıda Katkı Maddesi: Ekmek, peynir, şarap ve konserve sebzeler gibi çeşitli gıda ürünlerinde asit düzenleyici, hamur yumuşatıcı, maya besin maddesi ve sıkılaştırıcı madde olarak (NH4)2SO4 kullanılır. FDA bunu genel olarak güvenli olarak kabul ediyor.
- Diğer Kullanım Alanları: (NH4)2SO4 diğer amonyum tuzlarının, yangın söndürücülerin, alev geciktiricilerin, deri tabaklamanın, tekstil boyamanın, metal elektrokaplamanın ve analitik kimyanın yapımında kullanılabilir.
Sorular:
S: Amonyum sülfatın kimyasal formülü nedir?
C: Amonyum sülfatın kimyasal formülü (NH4)2SO4’tür. Bu, bir amonyum sülfat molekülünün iki amonyum iyonu (NH4)+ ve bir sülfat iyonu (SO4)2- içerdiği anlamına gelir.
S: Amonyum sülfat çözünür mü?
C: (NH4)2SO4 suda çözünür, ancak aseton, alkol ve eterde çözünmez. 0°C’de 100 gram suda 70,6 gram, 20°C’de 100 gram suda 74,4 gram ve 100°C’de 100 gram suda 103,8 gram çözünebilir.
S: Bir galon su başına ne kadar amonyum sülfat?
C: Bir galon su başına (NH4)2SO4 miktarı, istenen konsantrasyona ve suyun sıcaklığına bağlıdır. Örneğin, istenen konsantrasyon %10 (ağırlık/hacim) ve su sıcaklığı 20°C ise, galon su başına (NH4)2SO4 miktarı şöyle olur:
%10 (a/h) = 100 ml su başına 10 gram 1 galon = 3785,41 ml 10 gram x 3785,41 ml / 100 ml = 378,54 gram Dolayısıyla galon su başına (NH4)2SO4 miktarı 378,54 gramdır.
S: Amonyum sülfat ve kalsiyum klorürün sulu çözeltileri birleştirildiğinde reaksiyon meydana gelir mi?
C: Hayır, (NH4)2SO4 ve kalsiyum klorürün sulu çözeltileri birleştirildiğinde reaksiyon oluşmaz. Aslında bu iki tuz suda çözünür ve çözünmeyen çökelti oluşturmaz. Ortaya çıkan çözelti dört iyon içerir: amonyum (NH4)+, sülfat (SO4)2-, kalsiyum (Ca2+) ve klorür (Cl)-.
S: Proteinler amonyum sülfatla nasıl çökeltilir?
C: Proteinleri (NH4)2SO4 ile çökeltmek için aşağıdaki adımlar izlenebilir:
- Bilinen konsantrasyon ve hacimde sulu bir (NH4)2SO4 çözeltisi hazırlayın.
- Protein çözeltisini (NH4)2SO4 çözeltisine yavaşça ve karıştırarak ekleyin.
- Protein çökeltme miktarını belirlemek için karışımın bulanıklığını veya optik yoğunluğunu izleyin.
- Protein peletini süpernatandan ayırmak için karışımı santrifüjleyin.
- Süpernatantı atın ve fazla tuzu gidermek için protein peletini tampon veya suyla yıkayın.
- Daha fazla analiz veya kullanım için protein peletini uygun bir tamponda yeniden süspanse edin veya çözündürün.
S: 6,90 molekül amonyum sülfatta kaç gram var?
C: 6,90 (NH4)2SO4 molekülünün kaç gram olduğunu bulmak için Avogadro sayısını ve (NH4)2SO4’ün molar kütlesini kullanmamız gerekir. Avogadro sayısı 6,022 x 10^23’tür, bu da herhangi bir maddenin bir molünün şu kadar molekül içerdiği anlamına gelir. (NH4)2SO4’ün molar kütlesi 132,14 g/mol’dür, bu da bir mol (NH4)2SO4’ün bu kadar gram ağırlığında olduğu anlamına gelir. Dolayısıyla 6,90 (NH4)2SO4 molekülünde kaç gram bulunduğunu hesaplamak için şu formülü kullanabiliriz:
gram = molekül x molar kütle / Avogadro sayısı gram = 6,90 x 132,14 / 6,022 x 10^23 gram = 1,52 x 10^-21 Dolayısıyla 6,90 (NH4)2SO4 molekülünde 1,52 x 10^-21 gram bulunur.
S: Amonyum sülfatta ne kadar kükürt var?
C: (NH4)2SO4 kütlesel olarak %24 kükürt içerir. Bu, yüzde bileşim formülü ve kükürt ile (NH4)2SO4’ün molar kütleleri kullanılarak hesaplanabilir. Sülfürün molar kütlesi 32,06 g/mol ve (NH4)2SO4’ün molar kütlesi 132,14 g/mol’dür. Bu nedenle (NH4)2SO4’teki kükürt yüzdesi şöyledir:
yüzde = sülfürün molar kütlesi x 100 / amonyum sülfatın molar kütlesi yüzde = 32,06 x 100 / 132,14 yüzde = %24,26
Soru: Bu tuzlardan hangisi nötr tuzdur? na2so4 nacn kf (nh4)2so4
C: Nötr tuz, suda çözündüğünde çözeltinin pH’ını etkilemeyen tuzdur. Kuvvetli bir asit ile kuvvetli bir bazın tepkimesi sonucu oluşur. Verilen dört tuzdan yalnızca na2so4 nötr bir tuzdur. Sodyum hidroksit (kuvvetli bir baz) ve sülfürik asidin (kuvvetli bir asit) reaksiyonuyla oluşur. Diğer tuzlar ya asidik ya da baziktir. Nacn, sodyum hidroksit (kuvvetli bir baz) ve hidrosiyanik asidin (zayıf bir asit) reaksiyonuyla oluşan bazik bir tuzdur. Kf, potasyum hidroksit (güçlü bir baz) ve hidroflorik asidin (zayıf bir asit) reaksiyonuyla oluşan bazik bir tuzdur. (Nh4)2so4, amonyum hidroksit (zayıf bir baz) ve sülfürik asidin (kuvvetli bir asit) reaksiyonuyla oluşan bir asit tuzudur.
S: (nh4)2so4’ün molar kütlesi nedir?
A: (nh4)2so4’ün molar kütlesi 132,14 g/mol’dür. Molar kütleyi bulmak için formüldeki tüm atomların atom kütlelerini toplamamız gerekir. Atom kütleleri:
- Azot: 14,01 g/mol
- Hidrojen: 1,01 g/mol
- Kükürt: 32,06 g/mol
- Oksijen: 16,00 g/mol
Dolayısıyla (nh4)2so4’ün molar kütlesi:
(2 x 14,01) + (8 x 1,01) + 32,06 + (4 x 16,00) = 132,14 g/mol
S: (nh4)2so4 suda çözünür mü?
C: Evet (nh4)2so4 suda çözünür. 0°C’de 100 gram suda 70,6 gram, 20°C’de 100 gram suda 74,4 gram ve 100°C’de 100 gram suda 103,8 gram çözünebilir.
