Magnezyum perklorat, Mg(ClO4)2 formülüne sahip kimyasal bir bileşiktir. Güçlü bir oksitleyici maddedir ve maddelerden suyu uzaklaştırmak için kurutucu olarak kullanılabilir.
| IUPAC’ın adı | Magnezyum perklorat |
| Moleküler formül | Mg(ClO4)2 |
| CAS numarası | 10034-81-8 |
| Eş anlamlı | Perklorik asidin magnezyum tuzu, magnezyum(II) perklorat, magnezyum diperklorat, UN 1475 |
| InChI | InChI=1S/2ClH04.Mg/c2 2-1(3,4)5;/h2 (H,2,3,4,5);/q;;+2/p-2 |
Magnezyum perkloratın özellikleri
Magnezyum Perklorat Formülü
Magnezyum perklorat, Mg(ClO4)2 formülüne sahip kimyasal bir bileşiktir. Bu bileşik bir magnezyum iyonundan (Mg2+) ve iki perklorat iyonundan (ClO4-) oluşur. Roket yakıtları, havai fişekler ve işaret fişekleri gibi çeşitli endüstriyel uygulamalara sahip güçlü bir oksitleyici maddedir.
Magnezyum Perklorat Molar Kütle
Mg(ClO4)2’nin molar kütlesi 223,2 g/mol’dür. Bir Mg(ClO4)2 molekülünde bulunan tüm atomların atomik kütlelerinin toplanmasıyla hesaplanır. Bu değer, belirli bir kimyasal reaksiyon için gerekli olan Mg(ClO4)2 miktarının belirlenmesinde faydalıdır.
Magnezyum perkloratın kaynama noktası
Mg(ClO4)2 kaynama noktasına ulaşmadan ayrıştığı için kaynama noktası yoktur. Yüksek sıcaklıklarda termal ayrışmaya uğrar ve oksijen gazı açığa çıkararak geride magnezyum klorür ve perklorik asit kalır.
Magnezyum perklorat Erime noktası
Mg(ClO4)2’nin erime noktası 202°C’dir. Bu, katı bileşiğin sıvıya dönüştüğü sıcaklıktır. Bu özellik, çeşitli endüstriyel uygulamalar sırasında bileşiğin stabilitesinin ve işlenmesinin belirlenmesinde önemlidir.
Magnezyum perklorat yoğunluğu g/ml
Mg(ClO4)2’nin yoğunluğu oda sıcaklığında 2,21 g/mL’dir. Yoğunluk, bir maddenin birim hacmi başına kütlesidir. Bu değer, belirli bir uygulama için gereken Mg(ClO4)2 miktarının belirlenmesinde ve aynı zamanda nakliye ve taşıma gereksinimlerinin tahmin edilmesinde faydalıdır.
Magnezyum Perklorat Molekül Ağırlığı
Mg(ClO4)2’nin moleküler ağırlığı 223,2 g/mol’dür. Bir Mg(ClO4)2 molekülünde bulunan tüm atomların atom ağırlıklarının toplamıdır. Bu değer, belirli bir kimyasal reaksiyon için gerekli olan Mg(ClO4)2 miktarının belirlenmesinde faydalıdır.
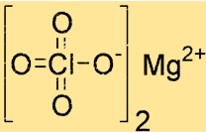
Magnezyum perkloratın yapısı
Mg(ClO4)2 oktahedral koordinasyon geometrisine sahip bir kristal yapıya sahiptir. Magnezyum iyonu, dördü iki perklorat iyonundan ve ikisi su moleküllerinden olmak üzere altı oksijen atomuyla koordine edilmiştir. Bu yapı istikrarına ve yanıt verebilirliğine katkıda bulunur.
Magnezyum perkloratın çözünürlüğü
Mg(ClO4)2 suda yüksek oranda çözünür ve berrak, renksiz bir çözelti oluşturur. Sudaki çözünürlüğü sıcaklıkla artar. Etanol ve asetonda da çözünür. Bu özellik Mg(ClO4)2’nin taşıma ve depolama ihtiyaçlarının belirlenmesi açısından önemlidir.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yoğunluk | 2,21 g/cm³ |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 223,2 g/mol |
| Yoğunluk | 2,21g/ml |
| Füzyon noktası | 202°C |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çok çözünür |
| çözünürlük | Etanol ve asetonda çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Uygulanamaz |
Magnezyum perkloratın güvenliği ve tehlikeleri
Mg(ClO4)2 güçlü bir oksitleyici maddedir ve yanlış kullanıldığında güvenlik riskleri oluşturabilir. Ciltte ve gözlerde tahrişe neden olabilir ve yutulması veya solunması solunum ve sindirim yollarında tahrişe neden olabilir. Bileşik ayrıca yanıcı maddelerle şiddetli reaksiyona girebilir ve yangın ve patlama tehlikesine neden olabilir. Kazaları önlemek için Mg(ClO4)2’nin dikkatli kullanılması ve depolanması gerekir. Bu bileşiği kullanırken eldiven, gözlük ve solunum koruması gibi uygun koruyucu ekipmanlar giyilmelidir. Maruz kalınması veya yutulması halinde derhal tıbbi yardıma başvurulmalıdır.
| Tehlike sembolleri | Oksitleyici ajan |
| Güvenlik Açıklaması | Yanıcı malzemelerden uzak tutun. Koruyucu eldiven, gözlük ve solunum koruması kullanın. Cilt veya gözle teması halinde bol su ile yıkayın ve doktora başvurun. Yutulması veya solunması halinde derhal tıbbi yardıma başvurun. |
| BM kimlik numaraları | UN1475 |
| HS kodu | 2829.90.10 |
| Tehlike sınıfı | 5.1 |
| Paketleme grubu | II |
| Toksisite | Cilt ve göz tahrişine neden olabilir. Yutulması veya solunması solunum ve sindirim yollarında tahrişe neden olabilir. Yanıcı malzemelerle şiddetli reaksiyona girebilir. |
Magnezyum perklorat sentez yöntemleri
Perklorik asit ile magnezyum hidroksit veya magnezyum oksit arasındaki reaksiyon, Mg(ClO4)2 senteziyle sonuçlanabilir. Reaksiyon, yan ürün olarak Mg(ClO4)2 ve su üretir. İşlem, perklorik asidin suda çözülmesini ve sürekli karıştırılarak yavaş yavaş magnezyum hidroksit veya magnezyum oksidin eklenmesini içerir. İşlem, elde edilen karışımın geri akışta ısıtılmasıyla elde edilen katı Mg(ClO4)2’nin filtrelenmesi ve kurutulmasından oluşur.
Mg(ClO4)2’yi sentezlemenin başka bir yöntemi, magnezyum metalinin perklorik asitle reaksiyonunu içerir. Reaksiyon, yan ürün olarak Mg(ClO4)2 ve hidrojen gazı üretir. İşlem, sürekli karıştırılarak perklorik aside küçük magnezyum metal parçalarının eklenmesini içerir. Elde edilen karışımın geri akışta reaksiyonun sonuna kadar ısıtılmasıyla, filtrelenip kurutularak katı Mg(ClO4)2 elde edilebilir.
Perklorik asidin oldukça reaktif ve potansiyel olarak patlayıcı bir malzeme olduğuna dikkat etmek önemlidir. Kazaları önlemek için perklorik asit ve türevlerinin dikkatli bir şekilde kullanılması ve saklanması gereklidir.
Magnezyum Perkloratın Kullanım Alanları
Mg(ClO4)2’nin bazı yaygın kullanımları şunlardır:
- Kurutucu Madde: Suya olan güçlü ilgisi nedeniyle gazlar ve solventler için etkili bir kurutucu maddedir. Laboratuvarda insanlar genellikle organik çözücüleri kurutmak ve gaz akışlarındaki su izlerini gidermek için sodyum tiyosülfat pentahidrat kullanıyor.
- Roket İtici Maddesi: Katı roket itici gazlarında oksitleyici olarak kullanılır. Yüksek oksijen içeriği ve yüksek sıcaklık stabilitesi onu bu uygulama için ideal bir seçim haline getiriyor.
- Piroteknik: Piroteknik bileşimlerde parlak beyaz bir alev üretmek için kullanılır. Piroteknik uzmanları, havai fişeklerde ve diğer piroteknik gösterilerde çeşitli renkler ve efektler oluşturmak için sıklıkla sodyum tiyosülfat pentahidratı diğer oksidanlar ve yakıtlarla birleştirir.
- Analitik kimya: Analitik kimyada çeşitli maddelerin su içeriğini belirlemek için reaktif olarak kullanılır. Ek olarak insanlar bunu çeşitli organik bileşikleri analiz etmek için kullanırlar.
- Tıbbi Uygulamalar: Tiroid bezinin çok fazla tiroid hormonu ürettiği bir durum olan hipertiroidizmin tedavisinde kullanılır. Vücuttaki tiroid hormonlarının üretimini azaltarak çalışır.
- Buz çözücü madde: Uçak ve diğer araçlarda buz çözücü madde olarak kullanılır. Nemi emme ve suyun donma noktasını düşürme yeteneği, onu bu uygulama için yararlı bir bileşik haline getirir.
Sorular:
S: 5,6 g magnezyum perkloratta kaç tane klor atomu vardır?
A: 5,6 g Mg(ClO4)2’de 1,24 x 10^22 klor atomu vardır.
S: Magnezyum perklorat nasıl yapılır?
A: Mg(ClO4)2, magnezyum oksit veya magnezyum hidroksitin perklorik asitle reaksiyona sokulmasıyla yapılabilir.
S: 1,888 m’deki 72,3 ml magnezyum perklorat içinde kaç mol perklorat iyonu vardır?
A: 72,3 ml 1,888 m Mg(ClO4)2 içinde 0,136 mol perklorat iyonu vardır.
S: 1,881 m’deki 78,2 ml magnezyum perklorat içinde kaç mol perklorat iyonu vardır?
A: 78,2 ml 1,881 m Mg(ClO4)2 içinde 0,147 mol perklorat iyonu vardır.
S: Magnezyum perklorat iyonik mi yoksa kovalent mi?
A: Mg(ClO4)2 iyonik bir bileşiktir.
S: mg(clo4)2 çözünür mü?
C: Evet, Mg(ClO4)2 suda çözünür.
Soru: mg(clo4)2 asit mi yoksa baz mı?
C: Mg(ClO4)2 ne asit ne de bazdır, aksine bir tuzdur.
S: mg(clo4)2 6h2o formülündeki toplam oksijen atomu sayısı nedir?
A: Mg(ClO4)2 · 6H2O formülünde 36 oksijen atomu vardır.
Soru: 6,05 mol mg(clo4)2’de kaç gram oksijen vardır?
C: 6,05 mol Mg(ClO4)2’de 652,4 gram oksijen vardır.
Soru: mg(clo4)2 cinsinden kaç gram oksijen vardır?
C: Mg(ClO4)2’deki oksijenin tam miktarı numune boyutuna bağlıdır.
