Potasyum perklorat (KClO4), potasyum, klor ve oksijen içeren bir bileşiktir. Oksitleyici özelliklerinden dolayı piroteknikte ve patlayıcılarda yaygın olarak kullanılır.
| IUPAC’ın adı | Potasyum perklorat |
| Moleküler formül | KClO4 |
| CAS numarası | 7778-74-7 |
| Eş anlamlı | Perkal K, Potas perklorat, Potasyum klorat (VII), UN 1489 |
| InChI | InChI=1S/ClH04.K/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Potasyum perkloratın özellikleri
Potasyum Perklorat Formülü
Potasyum perklorat, bir potasyum atomu, bir klor atomu ve dört oksijen atomu içerdiğini gösteren KClO4 kimyasal formülüne sahiptir. Bileşik, suda oldukça çözünür olan inorganik bir tuzdur ve bu da onu birçok uygulamada yararlı bir oksidan yapar.
Potasyum Perklorat Molar Kütle
KClO4’ün molar kütlesi, bileşiği oluşturan elementlerin atomik kütlelerinin eklenmesiyle hesaplanır. Potasyum, klor ve oksijenin atomik kütleleri sırasıyla 39,10 g/mol, 35,45 g/mol ve 16,00 g/mol’dür. Yani KClO4’ün molar kütlesi 138,55 g/mol’dür.
Potasyum perkloratın kaynama noktası
KClO4 kaynama noktasına ulaşmadan ayrıştığı için tanımlanmış bir kaynama noktasına sahip değildir. KClO4 yüksek sıcaklıklara ısıtıldığında potasyum klorür ve oksijen gazına ayrışır. Ancak bileşiğin 400 ila 500 °C civarındaki sıcaklıklarda süblimleşebildiği gözlemlenmiştir.
Potasyum perklorat Erime noktası
KClO4’ün erime noktası yaklaşık 610°C’dir. Bu sıcaklıkta katı bileşik sıvı duruma dönüşür. KClO4’ün yüksek erime noktası onu çeşitli endüstriyel uygulamalarda kullanıma uygun hale getirir.
Potasyum perklorat yoğunluğu g/mL
KClO4’ün yoğunluğu oda sıcaklığında yaklaşık 2,52 g/cm³’tür. Bu, bileşiğin yoğunluğu 1 g/cm³ olan sudan daha yoğun olduğunu gösterir. KClO4’ün yüksek yoğunluğu onu piroteknikte etkili bir oksidan yapar.
Potasyum Perklorat Molekül Ağırlığı
KClO4’ün moleküler ağırlığı 138,55 g/mol’dür. Bu değer, bileşiği oluşturan elementlerin atomik kütlelerinin eklenmesiyle belirlenir. KClO4’ün moleküler ağırlığı, belirli bir reaksiyon veya işlem için gerekli olan bileşiğin kütlesinin belirlenmesinde faydalıdır.
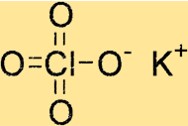
Potasyum perkloratın yapısı
KClO4 tetragonal bir kristal yapıya sahiptir, yani c ekseni etrafında dört kat simetriye sahiptir. Bileşiğin kristal kafesi, iyonik bağlarla bir arada tutulan potasyum iyonları, klor iyonları ve oksijen iyonlarından oluşur.
Potasyum perkloratın çözünürlüğü
KClO4, oda sıcaklığında yaklaşık 4,5 g/mL’lik bir çözünürlükle suda oldukça çözünür. Bileşik ayrıca etanol ve aseton gibi diğer polar çözücülerde de çözünür. Ancak benzen ve kloroform gibi polar olmayan çözücülerde çözünmez. KClO4’ün çözünürlüğü, çeşitli endüstriyel uygulamalarda oksidan olarak kullanılmasında önemli bir faktördür.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yoğunluk | 2.52 |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 138,55 gr/mol |
| Yoğunluk | 2,52 g/cm³ |
| Füzyon noktası | 610°C |
| Kaynama noktası | Kaynama noktasından önce ayrışır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 25°C’de 4,5 g/mL |
| çözünürlük | Etanol ve asetonda çözünür, benzen ve kloroformda çözünmez |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Doğal |
Potasyum perkloratın güvenliği ve tehlikeleri
KClO4, uygun şekilde kullanılmazsa güvenlik riskleri oluşturabilir. Bileşik güçlü bir oksidandır ve yanıcı maddelerle reaksiyona girerek yangına veya patlamaya neden olabilir. KClO4 tozunun veya buharının solunması da solunum sisteminin tahriş olmasına neden olabilir. Bileşiğe uzun süre maruz kalmak cilt tahrişine veya dermatite neden olabilir. KClO4 ile çalışırken eldiven, koruyucu gözlük ve solunum cihazı gibi uygun kişisel koruyucu ekipmanların kullanılması önemlidir. Bileşik aynı zamanda serin ve kuru bir alanda, uyumsuz malzemelerden ve ısı ve tutuşma kaynaklarından uzakta saklanmalıdır.
| Tehlike sembolleri | Oksitleyici |
| Güvenlik Açıklaması | Yanıcı malzemelerden uzak tutun. Uygun kişisel koruyucu ekipman giyin. Toz veya dumanı solumaktan kaçının. |
| BM kimlik numaraları | UN1489 |
| HS kodu | 2829.90.90 |
| Tehlike sınıfı | 5.1 – Oksitleyici maddeler |
| Paketleme grubu | II |
| Toksisite | Uzun süreli maruz kalma durumunda cilt tahrişine veya dermatite neden olabilir. Bileşiğin yutulması veya solunması solunum yolu tahrişine neden olabilir. |
Potasyum perklorat sentezi için yöntemler
KClO4 çeşitli yöntemlerle sentezlenebilir.
Yaygın bir yöntem, potasyum kloratın baryum perkloratla reaksiyona sokulmasıdır. Reaksiyon, filtrelenebilen bir yan ürün olarak KClO4 ve baryum klorür üretir.
Başka bir yöntem, potasyum kloratın hidroklorik asit ve sodyum klorür ile reaksiyonunu içerir. Reaksiyon, kristalleştirme yoluyla ayrılabilen KClO4 ve sodyum kloratı üretir.
Potasyum hidroksit ile amonyum perklorat arasındaki reaksiyon da KClO4’ü sentezleyebilir. Reaksiyon, filtreleme yoluyla ayrılabilen KClO4 ve amonyum hidroksiti üretir.
Başka bir yöntem, bir katalizör varlığında potasyum klorürün sodyum perklorat ile reaksiyonunu içerir. Reaksiyon, kristalleştirme yoluyla ayrılabilen KClO4 ve sodyum klorürü üretir.
Potasyum Perkloratın Kullanım Alanları
KClO4’ün farklı endüstrilerde çeşitli kullanımları vardır. Yaygın kullanımlarından bazıları şunlardır:
- Piroteknik: Piroteknik endüstrisinde popüler bir oksitleyici madde. Havai fişek, işaret fişeği ve diğer patlayıcı türlerinin üretiminde kullanılır.
- Roket Pervaneleri: Roket itici gazlarının üretiminde oksitleyici olarak kullanılır. Yaygın olarak katı roket iticilerinde ve uzay mekiği fırlatmalarında kullanılır.
- Hava Yastığı Başlatıcıları: Hava yastığı üretiminde başlatıcı olarak kullanılır. Hava yastığını açmak için KClO4 kaplı bir tel aracılığıyla elektrik yükü gönderilir. Bu, hava yastığını şişiren nitrojen gazı üreten bir reaksiyona neden olur.
- Kibritler: Emniyet kibritlerinin üretiminde kullanılır. Pürüzlü bir yüzeye çarptığında tutuşan yanıcı bir bileşik üretmek için antimon sülfür ve kükürt ile karıştırılır.
- Elektrokaplama: Elektrokaplama endüstrisinde metallerin elektrokaplanması için kullanılan elektrolitlerin bir bileşeni olarak kullanılır.
- İlaç: Hipertiroidizm gibi tiroid rahatsızlıklarının tedavisinde kullanılır. Ancak güvenlik endişeleri nedeniyle tıpta kullanımı azalmıştır.
- Analitik kimya: Analitik kimyada belirli maddelerin belirlenmesinde reaktif olarak da kullanılır.
Sorular:
S: Bir potasyum perklorat molekülünde ne tür bağlar bulunur?
C: KClO4 hem iyonik hem de kovalent bağlar içerir. K+ iyonu ve ClO4- iyonu iyonik bağlarla bir arada tutulurken perklorat iyonunun kendisi hem kovalent hem de iyonik bağlar içerir.
S: Potasyum perkloratın formülü nedir?
C: KClO4.
S: Potasyum perklorat sulu mu?
C: KClO4 suda çözünebilir ve belirli koşullar altında onu sulu hale getirebilir.
S: Potasyum perklorat ne için kullanılır?
C: KClO4’ün havai fişekler, roket güçlendiriciler ve hava yastığı şişiricileri dahil olmak üzere çeşitli uygulamaları vardır. Analitik kimyada reaktif ve oksitleyici madde olarak da kullanılır.
S: Potasyum perklorat olmadan flaş tozu nasıl yapılır?
C: Flaş tozu, amonyum perklorat, sodyum perklorat veya baryum peroksit gibi alternatif oksidanlar kullanılarak KClO4 olmadan yapılabilir.
S: KClO4’teki tek bir klor atomunun oksidasyon durumu nedir?
C: KClO4’teki bireysel klor atomunun oksidasyon durumu +7’dir.
S: KClO4 suda çözünür mü?
C: Evet, KClO4 suda çözünür.
Soru: KClO4 asit mi yoksa baz mı?
C: KClO4 ne asit ne de bazdır. Bir metal (potasyum) ve bir çok atomlu iyondan (perklorat) oluşan bir tuzdur.
