Sodyum perklorat, NaClO4 formülüne sahip kimyasal bir bileşiktir. Suda oldukça çözünür olan ve çeşitli endüstriyel işlemlerde yaygın olarak oksitleyici bir madde olarak kullanılan beyaz kristalli bir katıdır.
| IUPAC Adı | Sodyum perklorat |
| Moleküler formül | NaClO4 |
| CAS numarası | 7601-89-0 |
| Eş anlamlı | Perklorik asit, sodyum tuzu; Sodyum perklorat (Fransızca); Sodyum perklorat (Almanca); Perclorato di sodio (İtalyanca); Perclorato sodico (İspanyolca); BM 1502 |
| InChI | InChI=1S/ClH04.Na/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Sodyum perkloratın özellikleri
Sodyum perklorat formülü
Sodyum perkloratın kimyasal formülü NaClO4’tür. Bu, bileşiğin bir sodyum atomu, bir klor atomu ve dört oksijen atomundan oluştuğu anlamına gelir. Sodyum perklorat, çeşitli endüstriyel işlemlerde yaygın olarak kullanılan güçlü bir oksitleyici maddedir.
Sodyum Perklorat Molar Kütle
NaClO4’ün molar kütlesi 122,44 g/mol’dür. Bu, bir mol NaClO4’ün 122.44 gram bileşik içerdiği anlamına gelir. Bir bileşiğin molar kütlesi, bir kimyasal reaksiyon için gereken madde miktarının belirlenmesinde önemlidir.
Sodyum perkloratın kaynama noktası
NaClO4’ün kaynama noktası 545°C’dir (1013 hPa). Bu, bileşiğin sıvıdan gaza dönüştüğü sıcaklıktır. NaClO4, sodyum ve perklorat iyonları arasındaki güçlü elektrostatik kuvvetlerden dolayı yüksek bir kaynama noktasına sahiptir.
Sodyum perklorat Erime noktası
NaClO4’ün erime noktası 482°C’dir. Bu, bileşiğin katı halden sıvı duruma geçtiği sıcaklıktır. NaClO4, sodyum ve perklorat iyonları arasındaki güçlü elektrostatik kuvvetlerden dolayı yüksek bir erime noktasına sahiptir.
Sodyum perklorat yoğunluğu g/mL
NaClO4’ün yoğunluğu 2,52 g/mL’dir. Bu, bir mililitre NaClO4’ün 2,52 gram ağırlığında olduğu anlamına gelir. Bir maddenin yoğunluğu, kaldırma kuvveti ve viskozite gibi fiziksel özelliklerinin belirlenmesinde önemlidir.
Sodyum Perklorat Molekül Ağırlığı
NaClO4’ün moleküler ağırlığı 122,44 g/mol’dür. Bu, bileşikteki sodyum, klor ve oksijen atomlarının atom ağırlıklarının toplamıdır. Bir bileşiğin moleküler ağırlığı onun fiziksel ve kimyasal özelliklerinin belirlenmesinde önemlidir.
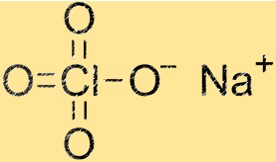
Sodyum perkloratın yapısı
NaClO4’ün yapısı, Na+ katyonları ve ClO4- anyonlarından oluşan bir kristal kafestir. Sodyum katyonları dört oksijen atomuyla çevrelenirken ClO4-anyonları bir klor atomu ve dört oksijen atomundan oluşur. Kristal kafes yapısı NaClO4’e karakteristik fiziksel ve kimyasal özelliklerini verir.
Sodyum perkloratın çözünürlüğü
NaClO4, 20°C’de 209 g/100 mL’lik bir çözünürlükle suda oldukça çözünür. Bu, büyük miktarda NaClO4’ün az miktarda suda çözünebileceği anlamına gelir. NaClO4’ün yüksek çözünürlüğü, onu roket yakıtı için amonyum perklorat üretimi gibi çeşitli endüstriyel işlemlerde faydalı kılar.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 2,52 gr/ml |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 122,44 gr/mol |
| Yoğunluk | 2,52 gr/ml |
| Füzyon noktası | 482°C |
| Kaynama noktası | 545°C (1013hPa) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 20°C’de 209 g/100 mL |
| çözünürlük | Suda ve etanolde çözünür |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | Müsait değil |
| pH | Müsait değil |
Sodyum perkloratın güvenliği ve tehlikeleri
NaClO4 dikkatle kullanılması gereken tehlikeli bir bileşiktir. Organik maddelerle, indirgeyici maddelerle ve diğer kimyasallarla şiddetli reaksiyona girebilen güçlü bir oksitleyici maddedir. NaClO4 tozuna veya buharına maruz kalmak gözlerde, ciltte ve solunum sisteminde tahrişe neden olabilir. NaClO4’ün yutulması mide-bağırsak tahrişine, mide bulantısına ve kusmaya neden olabilir. NaClO4 ayrıca sudaki yaşam için de zararlıdır ve uygun şekilde bertaraf edilmesi gerekir. Maruziyeti önlemek için NaClO4 ile çalışırken eldiven, gözlük ve solunum cihazı gibi kişisel koruyucu ekipmanlar giyilmelidir. Kaza riskini en aza indirmek için uygun havalandırma ve depolama da önemlidir.
| Tehlike sembolleri | O, Xn |
| Güvenlik Açıklaması | Tozunu/dumanını/gazını/sisini/buharını/spreyini solumayın. Koruyucu eldiven/koruyucu kıyafet/göz koruyucu/yüz koruyucu kullanın. SOLUNDUĞUNDA: Kazazedeyi temiz havaya çıkarın ve nefes alması kolay bir pozisyonda dinlenmesini sağlayın. YUTULMASI HALİNDE: Ağzınızı çalkalayın. Kusturmaya ÇALIŞMAYIN. Kendinizi iyi hissetmiyorsanız ZEHİR MERKEZİNİ veya doktoru arayın. |
| BM kimlik numaraları | UN1502 |
| HS kodu | 2829.90.90 |
| Tehlike sınıfı | 5.1 |
| Paketleme grubu | II |
| Toksisite | Yutulması halinde toksik, solunması veya cilt ile teması halinde zararlıdır. Tahrişe veya korozyona neden olabilir. |
Sodyum perklorat sentezi için yöntemler
NaClO4 çeşitli yöntemlerle sentezlenebilir.
Yaygın bir yöntem, sodyum kloratın hidroklorik asitle reaksiyonunu içerir ve bunun sonucunda NaClO4 ve sodyum klorür oluşur.
Başka bir yöntem, bir perklorat tuzu varlığında bir sodyum klorür çözeltisinin elektrolizini içerir. Sodyum klorürün sodyum klorata dönüşümü gerçekleşir, ardından onu NaClO4’e dönüştüren hidroklorik asit eklenir.
Başka bir yaklaşım, sodyum kloratın sülfürik asit varlığında sodyum klorürle reaksiyona sokulmasıdır. Bu yöntem, fraksiyonel kristalizasyonla ayrılabilen bir NaClO4 ve sodyum sülfat karışımı üretir.
Başka bir yöntem, sodyum kloratın amonyum perklorat ile reaksiyona girerek NaClO4 ve amonyum klorür üretmesini içerir. Katı roket yakıtlarında yaygın olarak oksidan olarak kullanılan NaClO4’ün üretimi bu yöntemin kullanılmasını içerir.
Sodyum hipokloritin hidroklorik asit varlığında sodyum kloratla reaksiyonu da NaClO4’ü sentezler. Bu yöntem ana ürünler olarak NaClO4 ve sodyum klorür üretir.
Sodyum perklorat kullanımı
NaClO4’ün farklı endüstrilerde çeşitli kullanımları vardır. NaClO4’ün bazı yaygın uygulamaları şunlardır:
- Roket İtici Maddeler: Yüksek oksijen içerikleri ve yüksek stabiliteleri nedeniyle katı roket itici gazlarında yaygın olarak oksitleyici olarak kullanılır.
- Piroteknik: İşaret fişekleri, havai fişekler ve işaret fişekleri gibi piroteknik bileşimlerde oksitleyici olarak kullanılır.
- Analitik Kimya: Analitik kimyada çeşitli numunelerdeki iyonların belirlenmesi için perklorat iyonlarının kaynağı olarak kullanılır.
- Elektrokaplama: Kaplama banyosunun iletkenliğini ve stabilitesini arttırmak için elektrokaplama çözümlerinde bir bileşen olarak kullanılır.
- Piller: Yüksek çözünürlüğü ve pilin elektrokimyasal özelliklerini geliştirme yeteneği nedeniyle lityum iyon pillerde elektrolit olarak kullanılır.
- Tıbbi Uygulamalar: Tiroid bozukluklarının tedavisinde iyot taşınmasının rekabetçi bir inhibitörü olarak kullanılır. Ayrıca tıbbi görüntüleme için kontrast maddelerinin üretiminde de kullanılır.
- Su Arıtma: Su arıtımında dezenfektan olarak ve sudaki bazı kirletici maddeleri uzaklaştırmak için kullanılır.
Sorular:
S: Sodyum perkloratın formülü nedir?
C: NaClO4.
S: Sodyum perklorat suda çözünür mü?
C: Evet, NaClO4 suda oldukça çözünür.
Soru: Sodyum perklorat asit mi yoksa baz mı?
Cevap: NaClO4 ne asit ne de bazdır. Tuz.
S: Amonyum perklorat ve sodyum bromürün reaksiyonu nedir?
C: Reaksiyon şu şekildedir: NH4ClO4 + NaBr → NaClO4 + NH4Br.
S: Sodyum perkloratta kaç tane sodyum iyonu vardır?
C: NaClO4’te sodyum iyonu vardır.
Soru: NaClO4 asit mi baz mı?
Cevap: NaClO4 ne asit ne de bazdır. Bu bir tuz.
S: NaClO4 çözeltisinde hangi çözünmüş türler bulunur?
C: Bir NaClO4 çözeltisinde çözünmüş türler Na+ ve ClO4- iyonlarıdır.
Soru: 3,30 mol NaClO4’te kaç mol oksijen vardır?
C: 3,30 mol NaClO4’te 13,2 mol oksijen vardır.
S: NaClO4 suda çözünür mü?
C: Evet, NaClO4 suda oldukça çözünür.
Soru: 1,10 mol NaClO4’te kaç mol oksijen vardır?
Cevap: 1,10 mol NaClO4’te 4,4 mol oksijen vardır.
