Potasyum klorat (KClO3), potasyum, klor ve oksijenden oluşan kimyasal bir bileşiktir. Oksitleyici özelliğinden dolayı kibrit, patlayıcı ve havai fişek yapımında yaygın olarak kullanılır.
| IUPAC Adı | Potasyum klorür |
| Moleküler formül | KClO3 |
| CAS numarası | 3811-04-9 |
| Eş anlamlı | Kaliumklorat, Klorkalik, Potasyum klorat, Potasyum perklorat, UN 1485, Potasyum klorat, Kalium perchloricum |
| InChI | InChI=1S/ClH3K03/c2-1(3)4/h(H3,2,3,4)/p-1 |
Potasyum kloratın özellikleri
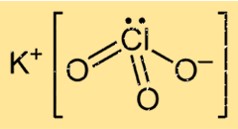
Potasyum Klorat Formülü
Potasyum kloratın, bir potasyum atomu, bir klor atomu ve üç oksijen atomundan oluştuğunu gösteren KClO3 kimyasal formülü vardır. K+ ve ClO3- iyonlarının iyonik bağ yoluyla birleşmesi sonucu oluşan iyonik bir bileşiktir. Bileşik, oksijenin varlığından dolayı çok reaktiftir ve ona güçlü oksitleyici özellikler kazandırır.
Potasyum Klorat Molar Kütlesi
KClO3’ün molar kütlesi 122,55 g/mol’dür. Bileşiği oluşturan potasyum, klor ve oksijen gibi bireysel elementlerin atom kütlelerinin toplamıdır. Molar kütle kimyada önemli bir parametredir çünkü kimyasal reaksiyonda belirli miktarda ürün üretmek için gereken maddenin kütlesini hesaplamak için kullanılır.
Potasyum kloratın kaynama noktası
KClO3 kaynama noktasına ulaşmadan ayrıştığı için iyi tanımlanmış bir kaynama noktasına sahip değildir. Isıtıldığında potasyum klorür ve oksijen gazına ayrışır. Bu nedenle KClO3 kaynama noktasından ziyade termal ayrışma reaksiyonuna girer.
Potasyum klorat Erime noktası
KClO3’ün erime noktası 356°C’dir (673°F). Bu sıcaklıkta katı bileşik erir ve sıvıya dönüşür. Erime noktası bir bileşiğin önemli bir özelliğidir çünkü çözünürlüğü ve yoğunluğu da dahil olmak üzere maddenin fiziksel davranışını etkiler.
Potasyum kloratın yoğunluğu g/mL
KClO3’ün yoğunluğu oda sıcaklığında 2,32 g/mL’dir. Bu, bileşiğin belirli bir hacminin belirli bir kütleye sahip olduğu anlamına gelir; bu, belirli bir kimyasal reaksiyon için gerekli olan bir maddenin kütlesinin belirlenmesinde faydalıdır. KClO3’ün yoğunluğu aynı zamanda sudaki çözünürlüğünü de etkiler çünkü daha yüksek yoğunluğa sahip bileşikler suda daha az çözünür olma eğilimindedir.
Potasyum Klorat Molekül Ağırlığı
KClO3’ün moleküler ağırlığı 122,55 g/mol’dür. Potasyum, klor ve oksijen gibi kendisini oluşturan atomların atom ağırlıklarının toplamıdır. Molekül ağırlığı stokiyometride önemli bir parametredir çünkü kimyasal bir reaksiyondaki reaktanların ve ürünlerin miktarlarını hesaplamak için kullanılır.
Potasyum Kloratın Yapısı
KClO3, katı formunda, belirli bir düzende düzenlenmiş potasyum, klor ve oksijen atomlarından oluşan bir kristal yapıya sahiptir. Bileşik, her bir potasyum iyonunun altı oksijen atomu ile çevrelendiği ve her bir oksijen iyonunun dört potasyum atomu ve iki klor atomu ile çevrelendiği, yüz merkezli bir kübik kristal kafes yapısı oluşturur.
Potasyum kloratın çözünürlüğü
KClO3 suda orta derecede çözünür ve oda sıcaklığında 7 g/100 ml su çözünürlüğüne sahiptir. Bileşiğin çözünürlüğü sıcaklıkla artar çünkü su molekülleri daha fazla kinetik enerjiye sahiptir ve bileşiğin daha fazlasını çözebilir. KClO3 ayrıca etanol ve aseton gibi diğer polar çözücülerde de çözünür.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 2,32 g/cm³ |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 122,55 gr/mol |
| Yoğunluk | 2,32 g/cm³ |
| Füzyon noktası | 356°C (673°F) |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 20°C’de 7 g/100 mL |
| çözünürlük | Etanol ve asetonda çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 1,8 (Ka = 1,6 × 10⁻⁵) |
| pH | 0,1 M’lik bir çözeltinin pH’ı yaklaşık 6,5 ila 7,5’tir. |
Potasyum kloratın güvenliği ve tehlikeleri
KClO3 oldukça reaktif ve potansiyel olarak tehlikeli bir maddedir, bu nedenle son derece dikkatli kullanılmalıdır. Ciddi cilt ve göz tahrişine neden olabilir ve yutulması veya solunması halinde toksik olabilir. Isıtıldığında şiddetli tepki verebilir ve hatta patlayabilir. KClO3 ayrıca sülfürik asit ve organik bileşikler gibi diğer kimyasallarla da güçlü bir şekilde reaksiyona girebilir ve klor ve klorat dioksit gibi zehirli gazlar üretebilir. KClO3 ile çalışırken koruyucu ekipman giymek ve iyi havalandırılmış bir alanda çalışmak da dahil olmak üzere uygun güvenlik protokollerinin takip edilmesi önemlidir.
| Tehlike sembolleri | O, Xi, N |
| Güvenlik Açıklaması | Yanıcı malzemelerle temastan kaçının. Yutulması halinde toksiktir. Ciddi cilt yanıklarına ve göz hasarına neden olur. |
| BM kimlik numaraları | UN1485 |
| HS kodu | 2829.90.10 |
| Tehlike sınıfı | 5.1 |
| Paketleme grubu | II |
| Toksisite | Çok zehirli |
Potasyum klorat sentez yöntemleri
KClO3’ü sentezlemek için çeşitli yöntemler vardır.
Bir yöntem , potasyum klorür ile ağartıcı arasındaki reaksiyonu içerir. Bu yöntem, bir potasyum klorür çözeltisine bir ağartma çözeltisinin eklenmesini ve karışımın karıştırılmasını içerir. KClO3’ü vermek için elde edilen çökeltiyi süzün ve yıkayın.
Başka bir yöntem, potasyum klorür , su ve bir oksijen kaynağı içeren bir çözeltinin elektrolizini içerir. Özel bir cihaz olan elektrolitik hücre, bu işlemi potasyum ve klorür iyonlarını ayırıp oksijen gazı üreterek gerçekleştirir. Oksijen potasyum iyonlarıyla reaksiyona girerek KClO3’ü oluşturur.
Üçüncü bir yöntem, potasyum hidroksit ile klor gazı arasındaki reaksiyonu içerir; bu reaksiyon, potasyum klorür ve su ile KClO3’ü verir. Bu yöntem, optimum verimi sağlamak için sıcaklığın ve reaktif konsantrasyonunun dikkatli bir şekilde kontrol edilmesini gerektirir.
Potasyum Kloratın Kullanım Alanları
KClO3’ün çeşitli endüstrilerde geniş bir kullanım alanı vardır:
- Piroteknik Ürünler: Havai fişeklerde ve diğer piroteknik cihazlarda yaygın olarak oksitleyici madde olarak kullanılır.
- Kibritler: Pürüzlü bir yüzeye vurulduğunda tutuşan emniyetli kibrit başlıklarında kullanılır.
- Gübre: Bitki gübrelerinde potasyum kaynağı olarak kullanılır.
- Ağartıcı: Tekstil, kağıt ve diğer malzemeler için ağartma maddesi olarak kullanılır.
- Laboratuvar Reaktifi: Çeşitli kimyasal reaksiyonlar için laboratuvar reaktifi olarak da kullanılır.
- Tıbbi Uygulamalar: Egzama gibi belirli cilt rahatsızlıklarını tedavi etmek için tıbbi olarak kullanılır.
- Patlayıcılar: Patlayıcılar ve dinamit gibi bazı patlayıcı türlerinde yaygın olarak kullanılan bir madde.
- Oksitleyici: Perkloratlar gibi bazı kimyasalların üretiminde oksitleyici madde olarak kullanılır.
Sorular:
Soru: 25 gram potasyum klorat ayrışırsa kaç gram potasyum klorür oluşur?
C: 25 g KClO3 ayrıştığında 13,47 g potasyum klorür oluşur.
S: Potasyum klorat nasıl yapılır?
C: KClO3, potasyum klorürün ağartıcı ile reaksiyona sokulması, potasyum klorür içeren bir çözeltinin elektrolizi yoluyla veya potasyum hidroksitin klor gazı ile reaksiyona sokulması yoluyla yapılabilir.
S: 2 mol potasyum klorat (kclo3) ayrıştığında kaç mol oksijen üretilir?
Cevap: 2 mol KClO3 ayrıştığında 3 mol oksijen gazı oluşur.
Soru: 0,70 m’lik bir çözelti 3,0 g potasyum klorat (kclo3) içerir. Çözeltinin hacmi nedir?
A: 3,0 g KClO3 içeren 0,70 m3 çözeltinin hacmi 51,4 mL’dir.
S: Potasyum klorat uçucu mudur?
C: KClO3, nispeten yüksek bir erime ve kaynama noktasına sahip olduğundan uçucu bir madde olarak kabul edilmez.
S: 2,50 g kclo3’ü ayrıştırırsanız ne kadar kcl üretilir?
C: 2,50 g KClO3 ayrıştığında 1,35 g potasyum klorür oluşur.
S: Kclo3 suda çözünür mü?
C: Evet, KClO3 suda yüksek oranda çözünür, oda sıcaklığında çözünürlüğü 7 g/100 mL’dir.
Soru: 100 g kclo3’ün ayrışmasından kaç gram oksijen üretilebilir?
A: 100 gr KClO3 bozunduğunda 45,02 gr oksijen gazı açığa çıkar.
