Magnezyum klorat (Mg(ClO3)2), Mg2+ ve ClO3- iyonlarından oluşan bir bileşiktir. Suda çözünür ve oldukça reaktif beyaz kristal bir tozdur. Havai fişek üretiminde oksitleyici madde olarak ve su arıtımında dezenfektan olarak kullanılabilir.
| IUPAC Adı | Magnezyum klorat |
| Moleküler formül | Mg(ClO3)2 |
| CAS numarası | 10326-21-3 |
| Eş anlamlı | Magnezyum diperklorat, magnezyum(II) klorat, magnezyum klorat hekzahidrat |
| InChI | InChI=1S/2ClH03.Mg/c2 2-1(3)4;/h2 (H,2,3,4);/q;;+2/p-2 |
Magnezyum kloratın özellikleri
Magnezyum Klorat Formülü
Magnezyum klorat, Mg(ClO3)2 formülüne sahip kimyasal bir bileşiktir. Bileşik bir magnezyum iyonu (Mg2+) ve iki ClO3 iyonundan oluşur. Kimyasal formül, bir magnezyum klorat molekülünün iki klorür iyonu ve altı oksijen atomu içerdiğini belirtir.
Magnezyum Klorat Molar Kütlesi
Mg(ClO3)2’nin molar kütlesi 191,2 g/mol’dür. Bu değer, Mg(ClO3)2 molekülünde bulunan elementlerin atom ağırlıkları toplanarak hesaplanır. Magnezyumun molar kütlesi 24,31 g/mol iken, klor ve oksijenin molar kütlesi sırasıyla 35,45 g/mol ve 16,00 g/mol’dür. Her elementin molar kütlesini, o elementin moleküldeki atom sayısıyla çarpıp bunları toplayarak bileşiğin molar kütlesini elde ederiz.
Magnezyum kloratın kaynama noktası
Mg(ClO3)2 kaynama noktasına ulaşamadan ayrışır. Mg(ClO3)2 ısıtıldığında magnezyum klorür, oksijen gazı ve klor gazına ayrışır. Bu nedenle Mg(ClO3)2’nin kaynama noktası yoktur.
Magnezyum klorat Erime noktası
Mg(ClO3)2’nin erime noktası 105°C’dir. Bu sıcaklıkta katı bileşik sıvı forma dönüşür. Mg(ClO3)2’nin erime noktası, bileşiğin saflığına ve ölçüldüğü koşullara bağlı olarak değişebilir.
Magnezyum kloratın yoğunluğu g/mL
Mg(ClO3)2’nin yoğunluğu 2,21 g/mL’dir. Bu, bir mililitre Mg(ClO3)2’nin kütlesinin 2,21 gram olduğu anlamına gelir. Mg(ClO3)2 yoğunluğu, bileşiğin belirli bir kütlesinin hacmini veya bileşiğin belirli bir hacminin kütlesini hesaplamak için kullanılabilir.
Magnezyum Klorat Molekül Ağırlığı
Mg(ClO3)2’nin moleküler ağırlığı 191,2 g/mol’dür. Bu değer, Mg(ClO3)2 molekülünde bulunan elementlerin atom ağırlıkları toplanarak hesaplanır.
Magnezyum kloratın yapısı
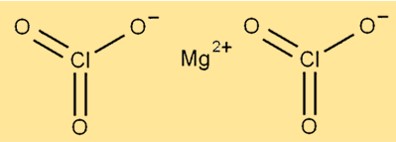
Mg(ClO3)2’nin yapısı altı oksijen atomu ve iki klor atomu ile çevrelenmiş magnezyum iyonlarından oluşur. Magnezyum iyonu molekülün merkezinde bulunurken, oksijen ve klor atomları onun etrafında düzenlenmiştir. Bileşik kristal yapıya sahiptir ve beyaz renktedir.
Magnezyum kloratın çözünürlüğü
Mg(ClO3)2 su, etanol ve asetonda çözünür. Mg(ClO3)2’nin sudaki çözünürlüğü sıcaklıkla artar. Oda sıcaklığında 100 ml suda yaklaşık 31 gram Mg(ClO3)2 çözünebilmektedir. Mg(ClO3)2’nin diğer çözücüler içindeki çözünürlüğü çözücünün polaritesine bağlıdır.
| Dış görünüş | Beyaz kristal toz |
| Spesifik yer çekimi | 2,21 gr/cm3 |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 191,2 g/mol |
| Yoğunluk | 2.21g/ml |
| Füzyon noktası | 105°C |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çözünür |
| çözünürlük | Suda, etanolde ve asetonda çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Uygulanamaz |
Magnezyum kloratın güvenliği ve tehlikeleri
Mg(ClO3)2 güçlü bir oksitleyici maddedir ve yanıcı maddelerle şiddetli reaksiyona girerek yangınlara veya patlamalara neden olabilir. Ayrıca temas veya solunması halinde ciltte, gözlerde ve solunum sisteminde tahrişe neden olabilir. Bu nedenle Mg(ClO3)2 ile çalışırken eldiven ve gözlük gibi uygun kişisel koruyucu ekipmanlar kullanılmalıdır. Bileşik ayrıca yanıcı malzemelerden ve ısı veya tutuşma kaynaklarından uzakta saklanmalıdır. Ek olarak, bileşikten toz veya buharın solunmasını önlemek için yeterli havalandırma sağlanmalıdır. Mg(ClO3)2 potansiyel tehlikelerden kaçınmak için dikkatle kullanılmalıdır.
| Tehlike sembolleri | Oksitleyici |
| Güvenlik Açıklaması | Yanıcı maddelerle temastan kaçının, eldiven ve koruyucu gözlük takın, yeterli havalandırma sağlayın |
| BM kimlik numaraları | UN1475 |
| HS kodu | 2829.90.90 |
| Tehlike sınıfı | 5.1 |
| Paketleme grubu | II |
| Toksisite | Ciltte, gözlerde ve solunum yollarında tahrişe neden olabilir; yutulması halinde zararlı olabilir |
Magnezyum Klorat Sentez Yöntemleri
Mg(ClO3)2 sentezinde farklı yöntemler kullanılabilmektedir.
Yaygın bir yöntem, magnezyum hidroksitin klorik asitle reaksiyona sokulmasıdır. Reaksiyon şu şekilde ilerler:
Mg(OH)2 + 2HClO3 → Mg(ClO3)2 + 2H2O
Diğer bir yöntem ise magnezyum karbonatın perklorik asitle reaksiyona sokulmasıdır. Reaksiyon şu şekilde ilerler:
MgCO3 + 2HClO4 → Mg(ClO4)2 + CO2 + H2O
Üçüncü bir yöntem, sodyum veya potasyum klorat gibi bir klorat tuzunun varlığında magnezyum klorürün elektrolizini içerir. Reaksiyon şu şekilde ilerler:
2MgCl2 + 2NaClO3 → Mg(ClO3)2 + 2NaCl
Bu yöntemde, elektroliz işleminde bir magnezyum anot kullanılır ve oksitleyici madde olarak klorat tuzu kullanılır.
Magnezyum Kloratın Kullanım Alanları
Mg(ClO3)2’nin farklı alanlarda çeşitli kullanımları vardır. İşte uygulamalarından bazıları:
- Piroteknik Ürünler: Yaygın olarak işaret fişekleri, havai fişekler ve sinyal cihazları gibi piroteknik bileşimlerde oksidan olarak kullanılır.
- Kimyasal sentez: İlaçlar, boyalar ve patlayıcılar dahil olmak üzere çeşitli kimyasalların sentezinde oksijen kaynağı olarak kullanılır.
- Ağartıcı: Kağıt, kağıt hamuru ve tekstil üretiminde ağartma maddesi olarak kullanılır.
- Su Arıtma: Suda bulunan yabancı maddeleri ve bakterileri gidermek için su arıtma maddesi olarak da kullanılır.
- Laboratuvar Reaktifi: Çeşitli analitik kimya yöntemlerinde laboratuvar reaktifi olarak kullanılır.
- Tarım: Bitkilere magnezyum ve oksijen sağlamak amacıyla gübre ve toprak düzenleyici olarak kullanılır.
- Petrol ve Gaz Endüstrisi: Petrol ve gaz endüstrisinde delme ve patlatma işlemlerinde oksitleyici olarak kullanılır.
Sorular:
S: Magnezyum kloratın formülü nedir?
C: Mg(ClO3)2.
Soru: 2,1 mol Mg(ClO3)2’de kaç atom vardır?
C: 2,1 mol Mg(ClO3)2’de 5,04 x 10^24 atom vardır.
S: Magnezyum klorat neye ayrılıyor?
C: Mg(ClO3)2 ısıtıldığında magnezyum klorür, oksijen gazı ve klor gazına dönüşebilir.
S: Magnezyum klorat nasıl parçalanır?
A: Mg(ClO3)2 ısıtıldığında magnezyum klorür ve oksijen gazına ayrışır.
Soru: Bir birim Mg(ClO3)2’de bulunan toplam oksijen atomu sayısı nedir?
Cevap: Bir birim Mg(ClO3)2’de 6 oksijen atomu vardır.
S: Mg(ClO3)2 neye ayrışır?
A: Mg(ClO3)2 ısıtıldığında MgCl2 ve O2’ye ayrışır.
Soru: Bir mol Mg(ClO3)2’de bulunan oksijen atomlarının toplam mol sayısı nedir?
Cevap: Bir mol Mg(ClO3)2’de 6 mol oksijen atomu vardır.
Soru: Mg(ClO3)2’nin gram cinsinden kütlesi nedir?
A: Mg(ClO3)2’nin gram cinsinden formül kütlesi 232,21 g/mol’dür.
S: Mg(ClO3)2 iyonik mi yoksa moleküler mi?
A: Mg(ClO3)2 iyonik bir bileşiktir.
