Potasyum hipoklorit (KClO), dezenfektan ve ağartıcı olarak yaygın olarak kullanılan kimyasal bir bileşiktir. Güçlü bir kokusu vardır ve uygun şekilde kullanılmazsa tehlikeli olabilir.
| IUPAC Adı | Potasyum hipoklorit |
| Moleküler formül | KClO |
| CAS numarası | 7778-66-7 |
| Eş anlamlı | Hipokloröz asit, potasyum tuzu; Potasyum oksiklorür; Potasyum klorat(I) |
| InChI | InChI=1S/ClO.K/h1H;/q;+1/p-1 |
Potasyum hipokloritin özellikleri
Potasyum Hipoklorit Formülü
Potasyum hipokloritin kimyasal formülü KClO’dur. Bir potasyum iyonu, bir klor atomu ve bir oksijen atomundan oluşur. Potasyum hipoklorit oda sıcaklığında beyaz bir katıdır ve güçlü bir klor kokusuna sahiptir. Çeşitli endüstrilerde dezenfektan ve ağartma maddesi olarak yaygın olarak kullanılır.
Potasyum Hipoklorit Molar Kütlesi
KClO’nun molar kütlesi 90,55 g/mol’dür. Kurucu elementler potasyum, klor ve oksijenin atomik kütlelerinin toplamıdır. Molar kütle, stokiyometri ve diğer kimyasal hesaplamalarda kullanılan önemli bir parametredir.
Potasyum hipokloritin kaynama noktası
KClO kaynama noktasına ulaşmadan ayrışır. Bu nedenle kaynama noktası iyi tanımlanmamıştır. Isıtıldığında potasyum klorür ve oksijen gazına ayrışır. KClO’nun ayrışması ekzotermik bir reaksiyondur ve doğru şekilde işlenmezse tehlikeli olabilir.
Potasyum hipoklorit Erime noktası
KClO’nun erime noktası 100 ila 102°C’dir. Oda sıcaklığında beyaz bir katıdır ve ısıtıldığında erir. Erime noktası bir maddenin önemli bir fiziksel özelliğidir ve maddeyi tanımlamak ve karakterize etmek için kullanılır.
Potasyum hipokloritin yoğunluğu g/ml
KClO’nun yoğunluğu 2,35 g/mL’dir. Bu, bir mililitre KClO’nun 2,35 gram ağırlığında olduğu anlamına gelir. Yoğunluk, bir maddenin birim hacmi başına kütlesinin bir ölçüsüdür ve kimyasal hesaplamalarda önemli bir parametredir.
Potasyum Hipoklorit Molekül Ağırlığı
KClO’nun moleküler ağırlığı 90,55 g/mol’dür. Bir KClO molekülünü oluşturan elementlerin atom ağırlıklarının toplamıdır. Molekül ağırlığı, molar kütlenin belirlenmesi ve stokiyometri gibi kimyasal hesaplamalarda kullanılır.
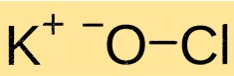
Potasyum hipokloritin yapısı
KClO kristal bir yapıya sahiptir. İyonik bağlarla bir arada tutulan K+ katyonları ve ClO-anyonlarından oluşur. KClO’nun yapısı diğer iyonik bileşiklerinkine benzer ve onu oluşturan iyonların yükü ve büyüklüğü ile belirlenir.
Potasyum hipokloritin çözünürlüğü
KClO suda çok çözünür. Suda çözündüğünde K+ katyonları ve ClO-anyonlarından oluşan bir çözelti oluşturur. KClO’nun sudaki çözünürlüğü sıcaklık ve pH’tan etkilenir. Daha yüksek sıcaklıklar ve daha düşük pH değerleri, KClO’nun sudaki çözünürlüğünü artırır.
| Dış görünüş | Beyaz katı |
| Spesifik yer çekimi | 2.35 |
| Renk | Beyaz |
| Koku | Güçlü klor kokusu |
| Molar kütle | 90,55 gr/mol |
| Yoğunluk | 2.35g/ml |
| Füzyon noktası | 100-102°C |
| Kaynama noktası | Kaynama noktasından önce ayrışır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çok çözünür |
| çözünürlük | Suda çözünebilir |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Alkali (pH 11-13) |
Potasyum Hipokloritin Güvenliği ve Tehlikeleri
KClO doğru şekilde kullanılmazsa tehlikeli olabilir. Tehlikeli bileşikler üretmek için organik malzemelerle reaksiyona girebilen güçlü bir oksitleyici maddedir. KClO aynı zamanda cilt, gözler ve solunum sistemi için de güçlü bir tahriş edicidir. Cilt ile doğrudan temas yanıklara ve tahrişe neden olabilir. KClO buharlarının solunması öksürüğe, hırıltıya ve nefes darlığına neden olabilir. Bileşik iyi havalandırılan bir alanda eldiven, gözlük ve solunum cihazı gibi uygun kişisel koruyucu ekipmanlarla kullanılmalıdır. Kazara maruz kalma durumunda derhal tıbbi yardıma başvurulmalıdır.
| Tehlike sembolleri | Oksitleyici |
| Güvenlik Açıklaması | Eldiven ve göz/yüz koruması kullanın. Yanıcı malzemelerden uzak tutun. Cilt ve gözlerle temasından kaçının. |
| BM kimlik numaraları | UN1748 |
| HS kodu | 2828.90.10 |
| Tehlike sınıfı | 5.1 |
| Paketleme grubu | II |
| Toksisite | Yutulması halinde zararlı olabilir. Ciddi cilt yanıklarına ve göz hasarına neden olur. Solunum yolu tahrişine neden olabilir. |
Potasyum hipoklorit sentezi için yöntemler
Potasyum hipokloritin sentezlenmesi için çeşitli yöntemler mevcuttur.
Yaygın bir yöntem, klor gazının bir potasyum hidroksit çözeltisiyle reaksiyona sokulmasıdır. Reaksiyon yan ürünler olarak KClO ve potasyum klorür üretir:
Cl2 + 2KOH → KCl + KClO + H2O
Başka bir yöntem, kalsiyum hipokloritin potasyum klorürle reaksiyonunu içerir. Bu reaksiyon yan ürünler olarak KClO ve kalsiyum klorür üretir:
Ca(ClO)2 + 2 KCl → 2 KClO + CaCl2
KClO’yu sentezlemek için hipokloröz asit, potasyum hidroksit ile reaksiyona sokulabilir.
2 KOH + HOCl → KClO + KCl + H2O
KClO üretmek için, su ve potasyum klorür çözeltisinden elektrik akımı geçirmek için elektroliz kullanılabilir. Reaksiyon yan ürünler olarak KClO, hidrojen gazı ve potasyum hidroksit üretir:
2 KCl + 2 H2O → 2 KOH + Cl2 + H2
Sentezlenen KClO serin ve kuru bir yerde, doğrudan güneş ışığı ve ısıdan uzakta saklanmalıdır.
Potasyum Hipokloritin Kullanım Alanları
KClO’nun çeşitli endüstrilerde ve uygulamalarda çeşitli kullanımları vardır. Yaygın kullanımlarından bazıları şunlardır:
- Su Arıtma: Su arıtma tesislerinde bakteri ve diğer zararlı organizmaları öldürmek amacıyla dezenfektan olarak kullanılır.
- Ağartıcı: Tekstil endüstrisinde kumaşları beyazlatmak için ağartma maddesi olarak kullanılır.
- Dezenfektan: Gıda endüstrisinde gıdayla temas eden yüzeyleri ve ekipmanları dezenfekte etmek için dezenfektan olarak kullanılır.
- Havuz Bakımı: Yüzme havuzlarında suyun temiz ve berrak tutulması amacıyla dezenfektan ve yosun öldürücü olarak kullanılır.
- Sterilizasyon: Tıbbi ortamlarda ve laboratuvarlarda ekipman ve yüzeylerin dezenfekte edilmesi için sterilizasyon amacıyla kullanılır.
- Koku Giderici: Kanalizasyon arıtma tesislerinde hoş olmayan kokuları nötralize etmek için koku giderici olarak kullanılır.
- Kağıt Hamuru ve Kağıt Endüstrisi: Kağıt hamuru ve kağıt endüstrisinde kağıt ürünleri için ağartıcı olarak kullanılır.
- Tarım: Tarımda bitkileri zararlılara ve hastalıklara karşı korumak amacıyla pestisit ve fungisit olarak kullanılır.
- Dezenfektan: Ev temizlik ürünlerinde mikrop ve bakterileri öldürmek için dezenfektan olarak kullanılır.
- Petrol ve Gaz Endüstrisi: Petrol ve gaz endüstrisinde, bakterileri kontrol etmek ve korozyonu önlemek amacıyla petrol kuyularını ve boru hatlarını arıtmak için kullanılır.
Sorular:
S: Potasyum hipoklorit nedir?
C: Potasyum hipoklorit, genellikle dezenfektan, ağartıcı ve su arıtma kimyasalı olarak kullanılan, KClO formülüne sahip kimyasal bir bileşiktir.
S: 0,42 M KClO çözeltisinin pH’ı nedir? [Ka(HClO) = 4,0 × 10–8]
A: 0,42 M KClO çözeltisinin pH’ı, eşlenik asidi HClO’nun Ka değeri kullanılarak hesaplanabilir. PH 12.69 civarındadır.
S: Sodyum hipoklorit ve potasyum hidroksit nedir?
C: Sodyum hipoklorit, genellikle ağartıcı ve dezenfektan olarak kullanılan, NaClO formülüne sahip kimyasal bir bileşiktir. Potasyum hidroksit, sabun üretiminde ve laboratuvar reaktifi olarak yaygın olarak kullanılan KOH formülüne sahip kimyasal bir bileşiktir.
S: 0,116 M sulu KClO çözeltisinin pH’ı nedir?
A: 0,116 M sulu KClO çözeltisinin pH’ı, eşlenik bazı olan ClO-‘nun Kb değeri kullanılarak hesaplanabilir. PH 11.31 civarındadır.
S: 0,191 M sulu KClO çözeltisinin pH’ı nedir?
A: 0,191 M sulu KClO çözeltisinin pH’ı, eşlenik bazı ClO-‘nun Kb değeri kullanılarak hesaplanabilir. PH 11.92 civarındadır.
S: KClO çözünür mü?
C: Evet, KClO suda çözünür ve alkali bir çözelti oluşturur.
S: Sodyum hipoklorit ile potasyum hipoklorit’i karıştırabilir miyim?
C: Sodyum hipoklorit ile KClO’nun karıştırılması tavsiye edilmez çünkü ısı, gazlar ve potansiyel olarak zararlı yan ürünler üreten kimyasal reaksiyona neden olabilir.
