Magnezyum bisülfit (Mg(HSO3)2), magnezyum, kükürt ve oksijenden oluşan kimyasal bir bileşiktir. Gıda endüstrisinde bozulmayı ve renk bozulmasını önlemek amacıyla koruyucu ve antioksidan olarak yaygın olarak kullanılmaktadır.
| IUPAC Adı | Magnezyum hidrojen sülfit |
| Moleküler formül | Mg(HSO3)2 |
| CAS numarası | 13774-25-9 |
| Eş anlamlı | Magnezyum bisülfit; Magnezyum hidrojen sülfit; Magnezya bisülfit |
| InChI | InChI=1S/2H2O3S.Mg/c2 1-4(2)3;/h2 (H2,1,2,3);/q;;+2/p-2 |
Magnezyum bisülfitin özellikleri
Magnezyum Bisülfit Formülü
Magnezyum bisülfitin kimyasal formülü Mg(HSO3)2’dir. Formül, bileşiğin bir molekülünde bulunan her bir elementin atom sayısını temsil eder. Magnezyum bisülfit formülü, bileşiğin geçebileceği kimyasal reaksiyonların belirlenmesi için gereklidir.
Magnezyum Bisülfit Molar Kütlesi
Mg(HSO3)2’nin molar kütlesi 186,45 g/mol’dür. Bu değer bileşiğin bir molünün gram cinsinden ağırlığını temsil eder. Bir bileşiğin molar kütlesi, kimyasal reaksiyonların gerçekleştirilmesi için bir maddenin ne kadarının gerekli olduğunu belirlemede esastır. Mg(HSO3)2’nin molar kütlesi, bileşikteki her bir elementin atom ağırlığının eklenmesiyle hesaplanır. Magnezyumun atom ağırlığı 24,305 g/mol, kükürtün atom ağırlığı 32,06 g/mol ve oksijenin atom ağırlığı 15,999 g/mol’dür.
Magnezyum bisülfitin kaynama noktası
Mg(HSO3)2 ısıtıldığında ayrıştığı için kaynama noktası yoktur. Ancak bir asit varlığında ısıtıldığında kükürt dioksit ve kükürt trioksit açığa çıkarabilir. Bu gazlar solunduğunda solunum sistemini tahriş edebilir ve ciddi sağlık etkilerine neden olabilir. Bu nedenle Mg(HSO3)2’yi dikkatli bir şekilde kullanmak ve endüstriyel proseslerde kullanırken güvenlik önlemlerine uymak önemlidir.
Magnezyum bisülfit Erime noktası
Mg(HSO3)2’nin erime noktası 110°C’dir. Bu değer, bileşiğin katı halden sıvı duruma geçtiği sıcaklığı temsil eder. Mg(HSO3)2’nin erime noktası düşüktür, bu da eritilmesini ve çeşitli endüstriyel işlemlerde kullanılmasını kolaylaştırır. Ancak yüksek sıcaklıklarda ayrışarak zararlı gazların açığa çıkmasına neden olabilir.
Magnezyum bisülfitin yoğunluğu g/mL
Mg(HSO3)2’nin yoğunluğu 2,35 g/mL’dir. Bu değer, bileşiğin bir mililitresinde bulunan gram cinsinden kütle miktarını temsil eder. Mg(HSO3)2’nin yoğunluğu, yoğunluğu 1 g/mL olan suyunkinden daha yüksektir. Mg(HSO3)2’nin yüksek yoğunluğu, onu gıda endüstrisinde koruyucu ve antioksidan olarak da dahil olmak üzere çeşitli uygulamalarda faydalı kılar.
Magnezyum Bisülfit Molekül Ağırlığı
Mg(HSO3)2’nin molekül ağırlığı 186,45 g/mol’dür. Bu değer bileşikteki tüm atomların atom ağırlıklarının toplamını temsil eder. Mg(HSO3)2’nin moleküler ağırlığı, kimyasal reaksiyonların gerçekleştirilmesi için gereken bileşik miktarının belirlenmesi için gereklidir.
Magnezyum bisülfitin yapısı
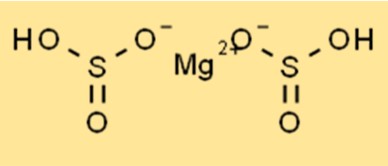
Mg(HSO3)2 kristal bir yapıya sahiptir ve ortorombik kristal sistemine aittir. Bileşik magnezyum katyonlarından (Mg2+) ve bisülfit anyonlarından (HSO3-) oluşur. Bisülfit anyonları tetrahedral, magnezyum katyonları ise oktahedraldir. Mg(HSO3)2’nin kristal yapısı onu kararlı hale getirir ve gıda koruyucusu da dahil olmak üzere çeşitli uygulamalarda kullanılmasına olanak tanır.
Magnezyum bisülfitin çözünürlüğü
Mg(HSO3)2 suda yüksek oranda çözünür ve 20°C’de yaklaşık 64 g/100 mL’lik bir çözünürlüğe sahiptir. Ayrıca metanolde çözünür, ancak çoğu organik çözücüde çözünmez. Mg(HSO3)2’nin çözünürlüğü sıcaklık ve pH gibi faktörlere bağlı olarak değişebilir.
| Dış görünüş | Beyaz toz |
| Spesifik yer çekimi | 2,35 gr/cm3 |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 186,45 gr/mol |
| Yoğunluk | 2.35g/ml |
| Füzyon noktası | 110°C |
| Kaynama noktası | ayrıştırılmış |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çözünür |
| çözünürlük | Suda ve etanolde çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 1.91 |
| pH | 4,5 – 5,5 |
Magnezyum Bisülfitin Güvenliği ve Tehlikeleri
Mg(HSO3)2 dikkatli kullanılmazsa çeşitli sağlık ve güvenlik riskleri oluşturabilir. Isıtıldığında veya asidik koşullara maruz bırakıldığında kükürt dioksit ve kükürt trioksit gazlarını açığa çıkarabilir. Bu gazlar solunduğunda solunum yolu tahrişine, öksürüğe ve nefes darlığına neden olabilir. Mg(HSO3)2 ayrıca temas halinde ciltte tahrişe ve kızarıklığa neden olabilir. Mg(HSO3)2 ile çalışırken eldiven ve gözlük gibi koruyucu kıyafet ve ekipman kullanılması önemlidir. Ayrıca serin ve kuru bir yerde, ısı kaynaklarından ve uyumsuz maddelerden uzakta saklanmalıdır. Uygun taşıma ve depolama prosedürleri, Mg(HSO3)2 ile ilişkili tehlike riskini en aza indirebilir.
| Tehlike sembolleri | Xi: Sinir bozucu |
| Güvenlik Açıklaması | Cilt ve gözlerle temasından kaçının. Koruyucu kıyafet ve ekipman giyin. Isıdan ve uyumsuz malzemelerden uzak tutun. |
| BM kimlik numaraları | BM 2693 |
| HS kodu | 2831.10.00 |
| Tehlike sınıfı | 8 – Aşındırıcı maddeler |
| Paketleme grubu | III |
| Toksisite | Cilt ve göz tahrişine neden olabilir. Solunması veya yutulması halinde zararlıdır. Solunum yolu tahrişine ve öksürüğe neden olabilir. |
Magnezyum bisülfit sentez yöntemleri
Mg(HSO3)2 çeşitli yöntemlerle sentezlenebilir:
- Magnezyum hidroksitin kükürt dioksit ile reaksiyonu: Magnezyum hidroksitin kükürt dioksit ile reaksiyonunda, iki madde reaksiyona girerek Mg(HSO3)2 ve su üretir.
- Magnezyum oksidin kükürt dioksit ile doğrudan reaksiyonu: Yüksek sıcaklıklarda kükürt dioksit gazı, Mg(HSO3)2 ve oksijen üretmek üzere magnezyum oksit ile doğrudan reaksiyona girer.
- Magnezyum sülfatın kükürt dioksit ile reaksiyonu: Bir indirgeyici maddenin varlığında magnezyum sülfat, kükürt dioksit gazı ile reaksiyona girerek Mg(HSO3)2 üretimine neden olur.
- Kükürt Dioksitli Magnezyum Karbonat : Magnezyum karbonat ile kükürt dioksit gazı arasındaki reaksiyon, Mg(HSO3)2 ve karbondioksit üretir.
- Magnezyum Oksit’in Sülfürik Asit ve Kükürt Dioksit ile Reaksiyonu: Magnezyum oksidin sülfürik asit ve kükürt dioksit gazı ile reaksiyona sokulması sırasında reaksiyon Mg(HSO3)2 ve su üretir.
Magnezyum Bisülfitin Kullanım Alanları
Mg(HSO3)2’nin farklı endüstrilerde çeşitli kullanımları vardır. İşte bazı yaygın uygulamalar:
- Yiyecek ve içecek endüstrisi: Yiyecek ve içecek endüstrisinde oksidasyonu ve mikrobiyal büyümeyi önlemek için koruyucu olarak kullanılır. Meyve suları, şarap ve biralarda yaygın olarak kullanılır.
- Su Arıtma: Su arıtımında klor ve diğer oksitleyici maddeleri uzaklaştırmak için indirgeyici madde olarak kullanılır. Suyun koku ve tadını kontrol etmede etkilidir.
- Tekstil endüstrisi: Tekstil endüstrisinde ağartma maddesi olarak kullanılır. Lekelerin çıkarılmasında ve kumaşların renginin iyileştirilmesinde etkilidir.
- İlaç endüstrisi: İlaç endüstrisinde indirgeyici madde olarak kullanılır. Çeşitli ilaç moleküllerinde nitro gruplarını amino gruplarına dönüştürmek için kullanılır.
- Kağıt Hamuru ve Kağıt Endüstrisi: Kağıt hamuru ve kağıt endüstrisinde ağartma maddesi olarak kullanılır. Odun hamurundan ligninin uzaklaştırılmasında ve kağıt parlaklığının arttırılmasında etkilidir.
- Tarım: Topraktaki magnezyum eksikliklerini düzeltmek için tarımda toprak düzenleyici olarak kullanılır. Ayrıca bitki büyümesini ve verimini arttırmak için yaprak gübresi olarak da kullanılır.
Sorular:
S: Magnezyum bisülfitin termodinamik özellikleri nelerdir?
C: Mg(HSO3)2’nin termodinamik özellikleri arasında 250°C kaynama noktası, 70-72°C erime noktası ve 1,84 g/mL yoğunluk yer alır.
S: Magnezyum bisülfitin kimyasal formülü nedir?
C: Magnezyum bisülfitin kimyasal formülü Mg(HSO3)2’dir.
S: Magnezyum bisülfiti nereden satın alabilirim?
C: Mg(HSO3)2 çeşitli kimyasal tedarikçilerinden ve distribütörlerinden satın alınabilir. Yaygın olarak büyük ve küçük miktarlarda bulunur. Sigma Aldrich, Fisher Scientific ve VWR International gibi bazı çevrimiçi platformlar da Mg(HSO3)2’yi satın alma olanağı sunuyor. Tedarikçinin saygın olduğundan ve ürünün amaçlanan uygulama için gerekli standartları karşıladığından emin olmak önemlidir.
