Potasyum nitrat (KNO3), gübrelerde, gıda muhafazasında ve havai fişeklerde sıklıkla kullanılan beyaz kristalli bir tuzdur. Ayrıca hassas dişlere yönelik bazı diş macunlarının da önemli bir bileşenidir.
| IUPAC Adı | Potasyum nitrat |
| Moleküler formül | KNO3 |
| CAS numarası | 7757-79-1 |
| Eş anlamlı | güherçile; potasyum nitrat; nitrür; güherçile; E252; Çin güherçilesi; nitrik asit, potasyum tuzu; Kalii Nitraları |
| InChI | InChI=1S/K.NO3/c;2-1(3)4/q+1;-1 |
Potasyum nitratın özellikleri
Potasyum nitrat formülü
Potasyum nitratın kimyasal formülü KNO3’tür. Bu formül, bileşiğin bir potasyum iyonu, bir nitrat iyonu ve üç oksijen iyonundan oluştuğunu gösterir. Formül, bir reaksiyonda ihtiyaç duyulan potasyum nitrat miktarının hesaplanmasında ve ayrıca bileşikte bulunan elementlerin ve iyonların tanımlanmasında faydalıdır.
Potasyum Nitrat Molar Kütlesi
KNO3’ün molar kütlesi 101,1 g/mol’dür. Molar kütle, bir maddenin bir molünün kütlesidir ve bileşikteki tüm atomların atomik kütlelerinin eklenmesiyle hesaplanır. KNO3 durumunda molar kütle, bir potasyum atomu, bir nitrojen atomu ve üç oksijen atomunun atomik kütlesinin eklenmesiyle hesaplanır. Bu değer, bir reaksiyonda ihtiyaç duyulan KNO3 miktarının belirlenmesinde ve konsantrasyon gibi diğer özelliklerin hesaplanmasında faydalıdır.
Potasyum nitratın kaynama noktası
KNO3, 1,336 °C (2,437 °F) gibi nispeten yüksek bir kaynama noktasına sahiptir. Bu, bileşiğin atomları arasındaki bağları kırmak ve onu sıvıdan gaza dönüştürmek için çok fazla enerji gerektiği anlamına gelir. Bu özellik KNO3’ü havai fişek üretimi gibi yüksek sıcaklık reaksiyonları gerektiren uygulamalarda faydalı kılar.
Potasyum Nitratın Erime Noktası
KNO3’ün erime noktası 334°C’dir (633°F). Bu, 334°C’nin üzerindeki sıcaklıklarda KNO3’ün katı halden sıvı hale geçeceği anlamına gelir. Bu özellik KNO3’ü silikanın erime noktasını düşürmek için bir akış maddesi olarak kullanıldığı cam yapımı gibi uygulamalarda faydalı kılar.
Potasyum nitratın yoğunluğu g/mL
KNO3’ün yoğunluğu oda sıcaklığında 2,109 g/mL’dir. Yoğunluk, bir maddenin birim hacmi başına kütlenin bir ölçüsüdür. KNO3’ün yoğunluğu gübre üretimi gibi azot ve potasyum kaynağı olarak kullanıldığı uygulamalarda önemlidir. Yoğunluk ayrıca belirli bir çözelti hacminde ihtiyaç duyulan KNO3 miktarının belirlenmesinde de faydalıdır.
Potasyum Nitrat Molekül Ağırlığı
KNO3’ün moleküler ağırlığı 101,1 g/mol’dür. Bu değer, bileşikteki tüm atomların atom ağırlıkları toplanarak hesaplanır. Molekül ağırlığı, bir reaksiyonda ihtiyaç duyulan KNO3 miktarı veya bir çözeltinin konsantrasyonu gibi KNO3’ün diğer özelliklerinin hesaplanmasında faydalıdır.
Potasyum nitratın yapısı
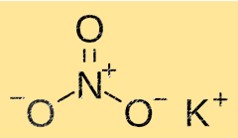
KNO3 potasyum, nitrat ve oksijen iyonlarından oluşan kristal bir yapıya sahiptir. Potasyum iyonları altı nitrat iyonu ile çevriliyken, nitrat iyonları altı potasyum iyonu ile çevrelenmiştir. Bu yapı KNO3’e çözünürlük, erime noktası ve yoğunluk gibi karakteristik özelliklerini verir.
| Dış görünüş | Beyaz kristal toz |
| Spesifik yer çekimi | 20°C’de 2,109 g/cm³ |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 101.1032 gr/mol |
| Yoğunluk | 2,109 gr/cm³ |
| Füzyon noktası | 334°C (633°F) |
| Kaynama noktası | 400°C (752°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 20°C’de 133 g/L |
| çözünürlük | Gliserol, amonyak ve suda çözünür |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 4.75 |
| pH | 6.9 – 7.3 |
Potasyum nitratın güvenliği ve tehlikeleri
KNO3 doğru şekilde kullanıldığında nispeten güvenlidir ancak yanlış kullanıldığında tehlikeler oluşturabilir. Oksitleyici olarak sınıflandırılır, yani diğer malzemelerin yanmasını teşvik edebilir. KNO3 ayrıca gözleri, cildi ve solunum yollarını tahriş edebilir ve büyük miktarlarda yutulması veya solunması halinde toksik olabilir. KNO3 ile çalışırken eldiven, gözlük ve solunum cihazı gibi koruyucu ekipmanların kullanılması ve yanıcı maddelerden uzak, serin ve kuru bir yerde saklanması önemlidir. Çevrenin kirlenmesini önlemek için uygun imha yöntemleri de takip edilmelidir.
| Tehlike sembolleri | O, Xn |
| Güvenlik Açıklaması | Isıdan/kıvılcımdan/açık alevden/sıcak yüzeylerden uzak tutun. Koruyucu eldiven/göz koruması/yüz koruması kullanın. YUTULMASI HALİNDE: Kendinizi iyi hissetmiyorsanız ZEHİR MERKEZİNİ/doktoru arayın. Ağzınızı çalkalayın. Kusturmaya ÇALIŞMAYIN. SOLUNDUĞUNDA: Kazazedeyi temiz havaya çıkarın ve nefes alması kolay bir pozisyonda dinlenmesini sağlayın. ZEHİR MERKEZİNİ/doktoru arayın. |
| BM kimlik numaraları | 1486 |
| HS kodu | 2834.21.00 |
| Tehlike sınıfı | 5.1 |
| Paketleme grubu | III |
| Toksisite | Solunması halinde solunum yolu tahrişine, öksürüğe ve nefes darlığına neden olabilir. Gözde ve ciltte tahrişe neden olabilir. Yutma karın ağrısına, mide bulantısına, kusmaya ve ishale neden olabilir. Büyük miktarlarda yutulması veya solunması halinde toksik olabilir. |
Potasyum nitrat sentez yöntemleri
KNO3’ü çeşitli yöntemler sentezleyebilir.
Yaygın bir yöntem, potasyum hidroksit ile nitrik asit arasındaki reaksiyondur. Reaksiyon kabı iki maddeyi karıştırır ve bunları genellikle 80°C civarındaki yüksek bir sıcaklığa ısıtır. Bundan sonra karışım soğur ve filtreleme işlemi katı KNO3’ü geri kazanır.
Diğer bir yöntem ise potasyum klorür ile sodyum nitrat arasındaki reaksiyondur. Bir kişi iki maddeyi bir reaksiyon kabında karıştırır ve bunları genellikle 600°C civarındaki yüksek bir sıcaklığa ısıtır.
Ortaya çıkan karışım erir ve daha sonra katılaşarak KNO3 kristalleri oluşturur.
Üçüncü bir yöntem, bir katalizör varlığında amonyağın nitrik asit ile oksidasyonunu içerir. Bu yöntem daha karmaşıktır ve genellikle endüstriyel ölçekte kullanılır.
KNO3 mağaralar ve yer altı yatakları gibi doğal kaynaklardan elde edilebilir. Ancak bu yöntem, düşük verim ve ekstrakte edilen KNO3’te mevcut olan safsızlıklar nedeniyle daha az yaygındır.
Potasyum Nitratın Kullanım Alanları
KNO3 kimyasal özelliklerinden dolayı çeşitli endüstrilerde geniş bir kullanım alanına sahiptir. KNO3’ün bazı yaygın kullanımları şunlardır:
- Gübre – Yüksek azot ve potasyum içeriği nedeniyle gübre olarak kullanılır. Meyve, sebze ve tütün gibi yüksek düzeyde potasyum gerektiren ürünler için özellikle faydalıdır.
- Gıdaların Korunması – Özellikle kurutulmuş etlerde gıda koruyucu olarak da kullanılır. Bakteri üremesini engelleyerek bozulmayı önler, böylece ürünün raf ömrünü uzatır.
- Piroteknik – Havai fişek ve diğer piroteknik cihazların üretiminde önemli bir unsurdur. Diğer malzemelerin yanmasını sağlamak için oksijen üreten bir oksidan görevi görür.
- Diş macunu – Diş hassasiyetini azaltmak için bazı diş macunlarına eklenir. Ağrı sinyallerinin diş sinirinden beyne iletilmesini engelleyerek çalışır.
- Tıbbi Kullanımları – İdrar söktürücü ve balgam söktürücü özellikleri nedeniyle tıbbi olarak kullanılır. Aynı zamanda anjina ve hipertansiyonu da tedavi eder.
- Endüstriyel Uygulamalar – Cam, seramik ve boya üretimi gibi çeşitli endüstriyel uygulamalarda da kullanılır.
Sorular:
Soru: Potasyum nitrat suda çözünür mü?
C: Evet, KNO3 suda oldukça çözünür. Oda sıcaklığında 100 gram su yaklaşık 37 gram KNO3’ü çözebilir.
Soru: Potasyum nitrat ne için kullanılır?
C: KNO3 gübre, gıda koruyucu, piroteknik oksidan, diş macunu bileşeni ve cam, seramik ve boya üretiminde bir bileşen olarak çeşitli amaçlarla kullanılır.
Soru: Potasyum nitrat nedir?
C: Güherçile olarak da bilinen potasyum nitrat, KNO3 formülüne sahip kimyasal bir bileşiktir. Potasyum iyonları (K+) ve nitrat iyonlarından (NO3-) oluşan iyonik bir tuzdur.
S: Potasyum nitratı nötralize eden nedir?
C: Kalsiyum ve magnezyum iyonları, bitkilerdeki aşırı KNO3’ün zararlı etkilerini ortadan kaldırabilir. İnsanlarda KNO3 zehirlenmesinin bilinen bir panzehiri yoktur ve tedavisi oldukça faydalıdır.
S: kno3 suda çözünür mü?
C: Evet, KNO3 suda oldukça çözünür.
S: Düşük konsantrasyonda kno3 içeren su elektrolizinin ürünü nedir?
C: Düşük konsantrasyonda KNO3 içeren su elektrolizinin ürünleri hidrojen gazı (H2) ve oksijen gazıdır (O2).
S: kno3 nedir?
C: KNO3, güherçile olarak da bilinen potasyum nitratın kimyasal formülüdür.
S: kno3’teki tek bir nitrojen atomunun oksidasyon durumu nedir?
C: KNO3’te her nitrojen atomunun oksidasyon durumu +5’tir.
S: kno3 asit mi yoksa baz mı?
C: KNO3 ne asit ne de bazdır. Bir katyon (K+) ve bir anyondan (NO3-) oluşan bir tuzdur.
