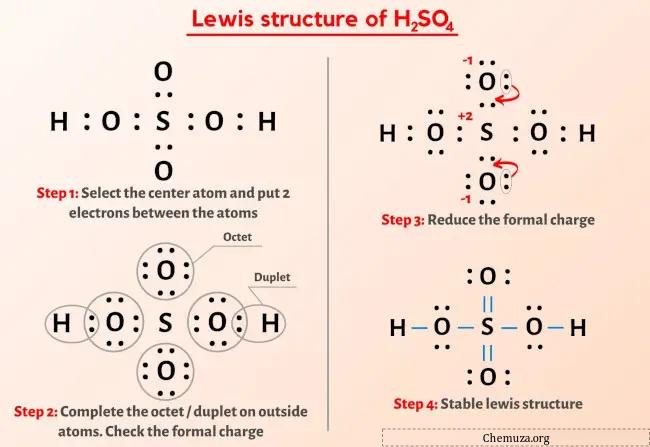
Yukarıdaki görseli zaten gördünüz değil mi?
Yukarıdaki görseli kısaca açıklayayım.
H2SO4 (sülfürik asit) Lewis yapısının merkezinde iki oksijen (O) atomu ve iki OH grubu ile çevrelenmiş bir kükürt (S) atomu bulunur. Kükürt (S) ve oksijen (O) atomları arasında çift bağ, kükürt (S) ile iki OH grubu arasında ise tek bağ vardır.
H2SO4’ün Lewis yapısının yukarıdaki görüntüsünden hiçbir şey anlamadıysanız, benimle kalın ve H2SO4’ün Lewis yapısının çizilmesine ilişkin ayrıntılı adım adım açıklamayı alacaksınız.
O halde H2SO4’ün Lewis yapısını çizme adımlarına geçelim.
H2SO4’ün Lewis Yapısını Çizim Adımları
Adım 1: H2SO4 molekülündeki toplam değerlik elektronu sayısını bulun
H2SO4 (sülfürik asit) molekülündeki toplam değerlik elektron sayısını bulmak için öncelikle hidrojen atomunda , kükürt atomunda ve oksijen atomunda bulunan değerlik elektronlarını bilmeniz gerekir.
(Değerlik elektronları herhangi bir atomun en dış yörüngesinde bulunan elektronlardır.)
Burada size periyodik tabloyu kullanarak hidrojen, kükürt ve oksijenin değerlik elektronlarını nasıl kolayca bulacağınızı anlatacağım.
H2SO4 molekülündeki toplam değerlik elektronları
→ Hidrojen atomunun verdiği değerlik elektronları:
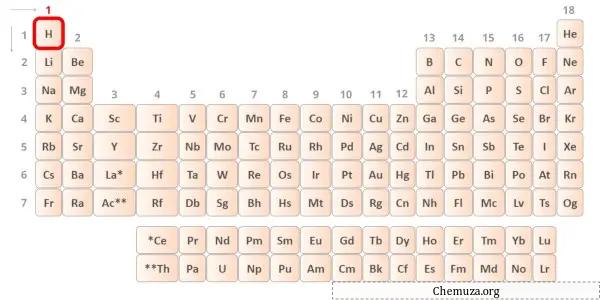
Hidrojen periyodik tablonun 1. grup elementidir. [1] Bu nedenle hidrojende bulunan değerlik elektronu 1’dir .

Yukarıdaki resimde gösterildiği gibi hidrojen atomunda yalnızca bir değerlik elektronunun bulunduğunu görebilirsiniz.
→ Kükürt atomunun verdiği değerlik elektronları:
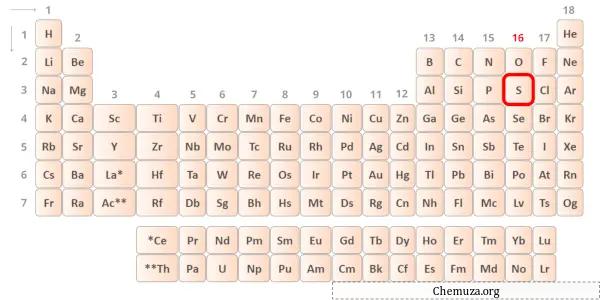
Kükürt periyodik tablonun 16. grubunda yer alan bir elementtir. [2] Bu nedenle kükürtte bulunan değerlik elektronları 6’dır .
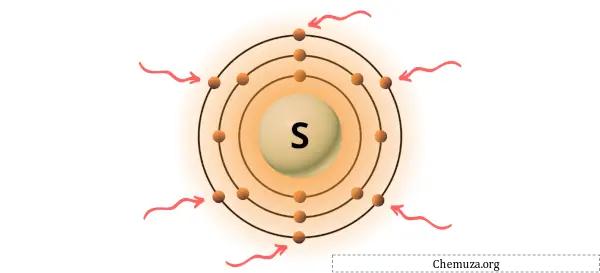
Yukarıdaki resimde gösterildiği gibi kükürt atomunda bulunan 6 değerlik elektronunu görebilirsiniz.
→ Oksijen atomunun verdiği değerlik elektronları:

Oksijen periyodik tablonun 16. grubunda yer alan bir elementtir. [3] Bu nedenle oksijende bulunan değerlik elektronları 6’dır .
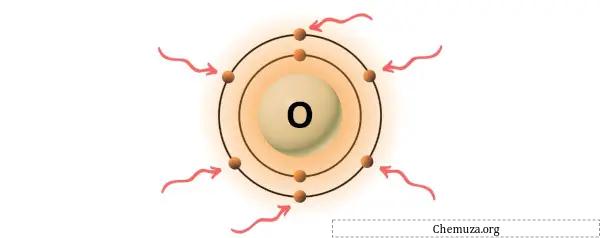
Yukarıdaki resimde gösterildiği gibi oksijen atomunda bulunan 6 değerlik elektronunu görebilirsiniz.
Bu yüzden,
H2SO4 molekülündeki toplam değerlik elektronları = 2 hidrojen atomu tarafından bağışlanan değerlik elektronları + 1 kükürt atomu tarafından bağışlanan değerlik elektronları + 4 oksijen atomu tarafından bağışlanan değerlik elektronları = 1(2) + 6 + 6 (4) = 32 .
Adım 2: Merkez atomu seçin
Merkez atomu seçmek için en az elektronegatif atomun merkezde kaldığını unutmamalıyız.
(Unutmayın: eğer verilen molekülde hidrojen varsa, daima hidrojeni dışarıya koyun.)
Şimdi burada verilen molekül H2SO4’tür ve hidrojen (H) atomları, kükürt (S) atomları ve oksijen (O) atomlarını içerir.
Yani kurala göre hidrojeni dışarıda tutmalıyız.
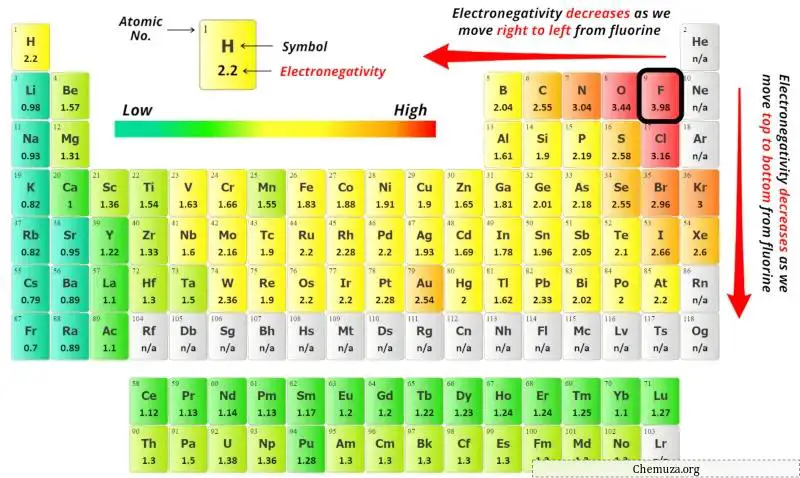
Artık yukarıdaki periyodik tabloda kükürt atomunun (S) ve oksijen atomunun (O) elektronegatiflik değerlerini görebilirsiniz.
Kükürt (S) ve oksijenin (O) elektronegatiflik değerlerini karşılaştırırsak kükürt atomunun elektronegatifliği daha azdır .
Burada kükürt (S) atomu merkez atom, oksijen (O) atomu ise dış atomdur.

Adım 3: Her atomu aralarına bir çift elektron yerleştirerek bağlayın
Şimdi H2SO4 molekülünde elektron çiftlerini kükürt (S) ve oksijen (O) atomları arasına ve oksijen (O) ve hidrojen (H) atomları arasına yerleştirmeniz gerekiyor.
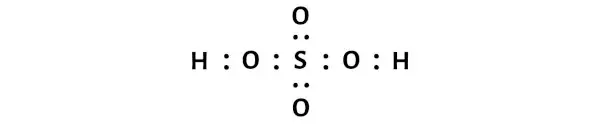
Bu, bir H2SO4 molekülünde bu atomların birbirine kimyasal olarak bağlandığını gösterir.
Adım 4: Dış Atomları Kararlı Hale Getirin
Bu adımda dış atomların kararlılığını kontrol etmeniz gerekir.
Burada H2SO4 molekülünün çiziminde dıştaki atomların hidrojen atomları ve oksijen atomları olduğunu görebilirsiniz.
Bu hidrojen ve oksijen atomları sırasıyla bir ikili ve bir oktet oluşturur ve bu nedenle stabildir.
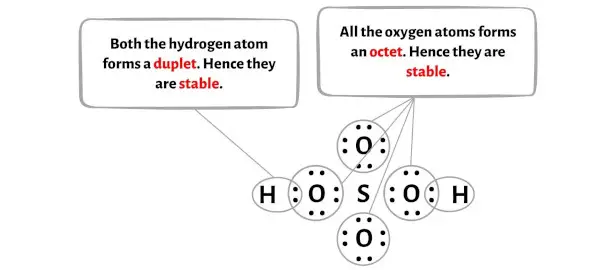
Ek olarak, 1. adımda H2SO4 molekülünde bulunan toplam değerlik elektronu sayısını hesapladık.
H2SO4 molekülünün toplam 32 değerlik elektronu vardır ve bu değerlik elektronlarının tümü yukarıdaki H2SO4 diyagramında kullanılmıştır.
Bu nedenle merkez atomda tutulacak daha fazla elektron çifti yoktur.
Şimdi bir sonraki adıma geçelim.
Adım 5: Merkezi atomdaki sekizliyi kontrol edin
Bu adımda merkezi kükürt atomunun (S) kararlı olup olmadığını kontrol etmeniz gerekir.
Merkezi kükürt (S) atomunun stabilitesini kontrol etmek için oktet oluşturup oluşturmadığını kontrol etmemiz gerekir.
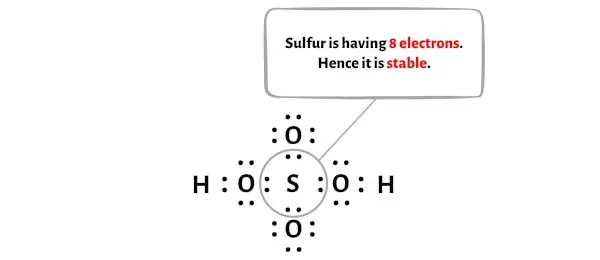
Yukarıdaki resimde kükürt atomunun bir oktet oluşturduğunu görebilirsiniz. Bu, 8 elektrona sahip olduğu anlamına gelir.
Ve böylece merkezi kükürt atomu kararlıdır.
Şimdi H2SO4’ün Lewis yapısının kararlı olup olmadığını kontrol etmek için son adıma geçelim.
Adım 6: Lewis yapısının kararlılığını kontrol edin
Artık H2SO4’ün Lewis yapısının kararlılığını kontrol etmeniz gereken son adıma geldiniz.
Lewis yapısının kararlılığı formal yük kavramı kullanılarak doğrulanabilir.
Kısacası artık H2SO4 molekülünde bulunan hidrojen (H), kükürt (S) ve oksijen (O) atomlarının formal yükünü bulmamız gerekiyor.
Resmi vergiyi hesaplamak için aşağıdaki formülü kullanmanız gerekir:
Resmi yük = Değerlik elektronları – (Bağ elektronları)/2 – Bağ yapmayan elektronlar
Aşağıdaki görüntüde H2SO4 molekülünün her bir atomu için bağlanan elektronların ve bağlanmayan elektronların sayısını görebilirsiniz.
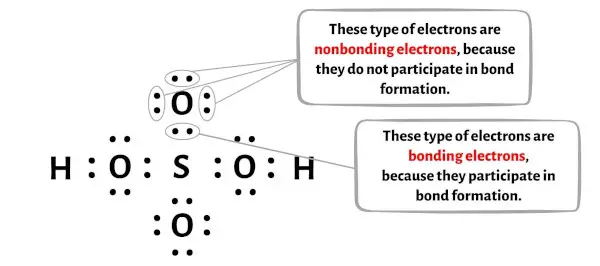
Hidrojen atomu (H) için:
Değerlik elektronu = 1 (çünkü hidrojen grup 1’dedir)
Bağ elektronları = 2
Bağlanmayan elektronlar = 0
Kükürt (S) atomu için:
Değerlik elektronları = 6 (çünkü kükürt 16. gruptadır)
Bağ elektronları = 8
Bağlanmayan elektronlar = 0
Oksijen atomu (O) için:
Değerlik elektronları = 6 (çünkü oksijen grup 16’dadır)
Bağ elektronları = 2
Bağlanmayan elektronlar = 6
Oksijen (O) atomu için (OH grubundan):
Değerlik elektronları = 6 (çünkü oksijen grup 16’dadır)
Bağ elektronları = 4
Bağlanmayan elektronlar = 4
| Resmi suçlama | = | değerlik elektronları | – | (Elektronların bağlanması)/2 | – | Bağlanmayan elektronlar | ||
| H | = | 1 | – | 2/2 | – | 0 | = | 0 |
| S | = | 6 | – | 8/2 | – | 0 | = | +2 |
| Ah | = | 6 | – | 2/2 | – | 6 | = | -1 |
| O (OH grubundan) | = | 6 | – | 4/2 | – | 4 | = | 0 |
Yukarıdaki formal yük hesaplamalarından, kükürt (S) atomunun +2 , iki oksijen atomunun ise -1 yüküne sahip olduğunu görebilirsiniz.
O halde bu yükleri H2SO4 molekülünün ilgili atomlarında tutalım.
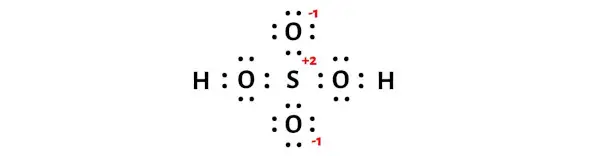
H2SO4’ün yukarıdaki Lewis yapısı stabil değildir. Bu yüzden elektron çiftlerini oksijen atomlarından kükürt atomuna taşıyarak bu yükleri en aza indirmemiz gerekiyor.
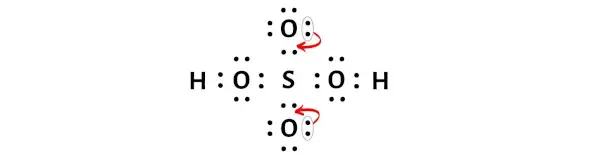
Elektron çiftinin oksijen atomlarından kükürt atomuna taşınmasından sonra H2SO4’ün Lewis yapısı daha kararlı hale gelir.
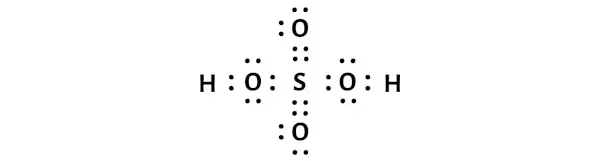
H2SO4’ün yukarıdaki Lewis nokta yapısında, her bir bağ elektronu çiftini (:) tek bir bağ (|) olarak da temsil edebilirsiniz. Bunu yapmak size H2SO4’ün aşağıdaki Lewis yapısını verecektir.
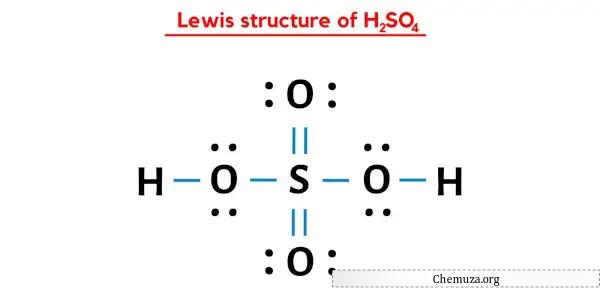
Umarım yukarıdaki tüm adımları tamamen anlamışsınızdır.
Daha fazla pratik yapmak ve daha iyi anlamak için aşağıda listelenen diğer Lewis yapılarını deneyebilirsiniz.
Daha iyi anlamak için şu Lewis yapılarını deneyin (veya en azından görün):
