Brom (Br2), iki brom atomundan oluşan diatomik bir moleküldür. Oda sıcaklığında kırmızımsı kahverengi bir sıvıdır ve çok reaktiftir. İlaç, tarım ve su arıtma gibi çeşitli endüstrilerde kullanılmaktadır.
| IUPAC Adı | Brom |
| Moleküler formül | Br2 |
| CAS numarası | 7726-95-6 |
| Eş anlamlı | Bromo, Moleküler brom, UN 1744, Diatomik brom, Brom-79, Brom-81 |
| InChI | InChI=1S/Br2/c1-2 |
Bromun özellikleri
Brom formülü
Bromun kimyasal formülü Br2’dir. Bu, bir brom molekülünün iki brom atomu içerdiği anlamına gelir. Formül, bir maddenin bileşimini temsil etmek için kullanılır ve kimyasal reaksiyonlarda esastır. Brom formülü ilaç, su arıtma ve tarım dahil olmak üzere çeşitli endüstrilerde kullanılmaktadır.
Brom Molar Kütlesi
Br2’nin molar kütlesi 159,808 g/mol’dür. Bir mol Br2 molekülünün kütlesidir. Molar kütle kimyada önemli bir özelliktir çünkü belirli bir reaksiyon için gereken madde miktarının belirlenmesine yardımcı olur. Ayrıca bir maddenin gramını ve molünü dönüştürmek için de kullanılır.
Bromun kaynama noktası
Br2’nin kaynama noktası 58,8°C’dir (137,8°F). Bu, Br2’nin sıvıdan gaza dönüştüğü sıcaklıktır. Br2’nin düşük kaynama noktası, moleküllerin sıvı halden daha kolay kaçmasına izin veren zayıf moleküller arası kuvvetlerden kaynaklanmaktadır. Br2’nin yüksek reaktivitesi onu yüksek sıcaklıklarda işlenmesi tehlikeli bir madde haline getirir.
Bromun erime noktası
Br2’nin erime noktası -7,2°C’dir (19,0°F). Bu, katı Br2’nin sıvı duruma geçtiği sıcaklıktır. Br2’nin düşük erime noktası, moleküllerin katı halde daha kolay hareket etmesini sağlayan zayıf moleküller arası kuvvetlerden kaynaklanmaktadır. Br2, halojenler arasında nadir görülen, oda sıcaklığında sıvı halde bulunma özelliğine sahiptir.
Brom yoğunluğu g/mL
Br2’nin yoğunluğu 3,12 g/mL’dir. Bu, bir mililitre Br2’nin kütlesinin 3,12 gram olduğu anlamına gelir. Br2’nin yüksek yoğunluğu, moleküler ağırlığından ve moleküllerinin sıvı haldeki sıkılığından kaynaklanmaktadır. Br2’nin yüksek yoğunluğu onu ağır organik sentez reaksiyonlarında faydalı kılar.
Brom Molekül Ağırlığı
Br2’nin moleküler ağırlığı 79,90 g/mol’dür. Br2 molekülündeki iki Br atomunun atom ağırlıklarının toplamıdır. Molekül ağırlığı kimyada önemli bir özelliktir çünkü belirli bir reaksiyon için gerekli olan madde miktarının belirlenmesine yardımcı olur.
Bromun yapısı
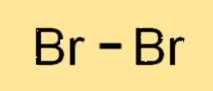
Br2 diatomik bir moleküldür, yani birbirine bağlı iki Br atomundan oluşur. İki Br2 atomu bir çift elektronu paylaşarak kovalent bir bağ oluşturur. Br2 molekülü, iki Br atomunun düz bir çizgi halinde düzenlendiği doğrusal bir yapıya sahiptir. Br2’nin yapısı klor ve iyot gibi diğer halojenlere benzer.
| Dış görünüş | Kırmızımsı kahverengi sıvı |
| Spesifik yer çekimi | 3,12g/ml |
| Renk | kırmızımsı kahverengi |
| Koku | Keskin ve rahatsız edici koku |
| Molar kütle | 159.808 gr/mol |
| Yoğunluk | 3.12g/ml |
| Füzyon noktası | -7,2°C (19,0°F) |
| Kaynama noktası | 58,8°C (137,8°F) |
| Flaş noktası | Yanıcı değil |
| sudaki çözünürlük | 3,41g/100ml (25°C) |
| çözünürlük | Kloroform, karbon tetraklorür ve eterde çözünür |
| Buhar basıncı | 25°C’de 1,13 kPa |
| Buhar yoğunluğu | 5,4 g/L |
| pKa | -5 |
| pH | Uygulanamaz |
Bromun güvenliği ve tehlikeleri
Br2 tehlikeli bir kimyasaldır ve dikkatle kullanılmalıdır. Ciltte ve gözlerde ciddi tahrişe neden olabilecek aşındırıcı bir sıvıdır. Br2 buharlarının solunması solunum problemlerine neden olabilir ve yüksek seviyelere maruz kalmak ölümcül olabilir. Br2 aynı zamanda güçlü bir oksitleyici maddedir ve yanıcı maddelerle şiddetli reaksiyona girerek yangınlara veya patlamalara neden olabilir. Br2 ile çalışırken daima eldiven, gözlük ve solunum cihazı gibi uygun koruyucu ekipmanlar giyilmelidir. Serin, kuru, iyi havalandırılmış bir alanda, ısı kaynaklarından ve uyumsuz maddelerden uzakta depolanmalıdır. Dökülme veya kaza durumunda alanı derhal boşaltın ve uygun temizlik prosedürlerini izleyin.
| Tehlike sembolleri | Kafatası ve Kemiklerin, Aşındırıcı |
| Güvenlik Açıklaması | Çok toksik, aşındırıcı ve cildi, gözleri ve solunum sistemini tahriş edicidir. |
| BM kimlik numaraları | UN1744 |
| HS kodu | 2801.30 |
| Tehlike sınıfı | 8 |
| Paketleme grubu | II |
| Toksisite | LD50 (oral, sıçan) = 2 ila 3 mg/kg |
Brom sentezi yöntemleri
İstenilen saflık ve miktara bağlı olarak Br2’yi sentezlemek için farklı yöntemler kullanılabilir.
Bir yöntem, tuzlu suyun demir gibi bir katalizör varlığında klor gazıyla işlenmesini içerir. Elde edilen sodyum hipoklorit ve sodyum klorür çözeltisi daha sonra hidroklorik asitle asitleştirilir ve bu da Br2 gazı açığa çıkarır.
Başka bir yöntem, platin veya asbest gibi bir katalizör varlığında hidrojen bromür gazının oksijen gazı ile oksidasyonunu içerir. Endüstriler, uygulamaları için yüksek saflıkta Br2 üretmek amacıyla yaygın olarak bu yöntemi kullanır.
Elektroliz, sodyum ve klorür iyonlarını ayıran ve bir yan ürün olarak Br2 gazı üreten çözeltiden bir elektrik akımı geçirerek tuzlu sudan Br2’yi çıkarır.
Bromun Kullanım Alanları
Br2’nin çeşitli endüstrilerde birçok önemli kullanımı vardır:
- Üreticiler, alevlerin yayılmasını önleyerek yangın riskini azaltmak için tekstil, plastik ve elektronik ekipmanlarda alev geciktirici olarak Br bazlı bileşikler kullanıyor.
- İlaç şirketleri çeşitli sakinleştirici, sakinleştirici ve analjeziklerin üretiminde Br bazlı bileşikleri kullanır.
- Su arıtma tesisleri, bakterileri, virüsleri ve diğer zararlı organizmaları etkili bir şekilde öldürmek için dezenfektan olarak Br bazlı bileşikleri kullanır.
- Pestisit ve herbisit üreticileri, zararlıları ve yabani otları etkili bir şekilde kontrol etmek için Br bazlı bileşikleri kullanır.
- Petrol ve gaz endüstrisi, korozyonu kontrol etmek ve petrol geri kazanımını iyileştirmek için sondaj operasyonlarında Br bazlı bileşikler kullanır.
- Üreticiler, görüntülerin hassasiyetini ve kontrastını etkili bir şekilde kontrol etmek için fotoğraf filmleri ve kağıtları üretiminde Br bazlı bileşikler kullanıyor.
- Kimyasal sentez reaksiyonları, boyalar, plastikler ve farmasötikler üretmek için Br2’yi reaktan olarak kullanır.
Sorular:
S: Br2 polar mı yoksa polar değil mi?
C: Br2 polar olmayan bir moleküldür çünkü her iki brom atomu da aynı elektronegatifliğe sahiptir, bu da kovalent bağda elektronların eşit paylaşılmasına neden olur.
S: Hangi bileşik büyük olasılıkla polar kovalent bağlar içerir? NaCl, AlF3, Br2, NF3?
C: Büyük olasılıkla polar kovalent bağlar içeren bileşik NF3’tür (nitrojen triflorür), çünkü nitrojen ve flor atomları çok farklı elektronegatifliklere sahiptir, bu da kovalent bağda elektronların eşit olmayan şekilde paylaşılmasına neden olur.
S: Bu reaksiyon için ΔH0 nedir? Br2 (g) → Br2 (l), ΔHf° Br2 (g) = 30,91 kJ/mol
C: Reaksiyonun ΔH0’ı -10,57 kJ/mol’dür, çünkü Br2’nin buharlaşma ısısı 41,48 kJ/mol ve füzyon ısısı 30,91 kJ/mol’dür (soruda verilmiştir).
S: Br2 bir gaz mıdır?
C: Br2, sıcaklık ve basınç koşullarına bağlı olarak gaz ve sıvı halde bulunabilir. Oda sıcaklığında ve standart basınçta Br2 kırmızımsı kahverengi bir sıvıdır.
S: Brom ne için kullanılır?
C: Bromun, alev geciktiriciler, su arıtma, farmasötikler, böcek ilaçları, petrol ve gaz endüstrisi, fotoğrafçılık ve kimyasal sentez dahil olmak üzere çeşitli endüstrilerde birçok önemli kullanımı vardır.
Soru: Brom bir metal midir?
C: Hayır, brom bir metal değildir. Periyodik tablonun halojen grubunda yer alan metalik olmayan bir elementtir.
