Potasyum peroksit (K2O2), potasyum ve oksijenden oluşan bir bileşiktir. Çeşitli kimyasal reaksiyonları kolaylaştırmak için endüstrilerde ve laboratuvarlarda sıklıkla güçlü bir oksitleyici ajan olarak kullanılır.
| IUPAC Adı | Potasyum peroksioksidanit |
| Moleküler formül | K2O2 |
| CAS numarası | 17014-71-0 |
| Eş anlamlı | Potasyum süperoksit; Dipotasyum dioksit; Potasyum dioksit; Perpotasyum oksit |
| InChI | InChI=1S/2K.O2/c;;1-2/q2*+1;-2 |
Potasyum peroksitin özellikleri
Potasyum Peroksit Formülü
Potasyum peroksitin kimyasal formülü K2O2’dir. Bu formül, molekülde bulunan atomların sayısını ve türünü temsil eder. Formül, maddenin tanımlanması ve kimyasal özelliklerinin anlaşılması açısından önemlidir.
Potasyum Peroksit Molar Kütlesi
K2O2’nin molar kütlesi 110,2 g/mol’dür. Bu, bir mol K2O2’nin 110,2 gram ağırlığında olduğu anlamına gelir. Molar kütle bir maddenin önemli bir özelliğidir çünkü belirli bir kütle veya hacimde bulunan maddenin miktarını hesaplamanıza olanak tanır.
Potasyum peroksitin kaynama noktası
K2O2’nin belirli bir kaynama noktası yoktur çünkü kaynama noktasına ulaşmadan ayrışır. Yüksek sıcaklıklarda K2O2, potasyum oksit ve oksijen gazına ayrışır. Bu nedenle genellikle yüksek sıcaklık uygulamalarında kullanılmaz.
Potasyum Peroksitin Erime Noktası
K2O2’nin erime noktası 655°C’dir. Bu yüksek erime noktası, onu yüksek sıcaklık reaksiyonlarında uygun bir oksitleyici madde haline getirir. Ancak yüksek sıcaklıklara veya neme maruz kalması durumunda erime noktasına ulaşmadan ayrışabileceğini unutmamak önemlidir.
Potasyum peroksitin yoğunluğu g/mL
K2O2’nin yoğunluğu 2,08 g/mL’dir. Bu yüksek yoğunluk onu suda batan yoğun bir katı haline getirir. K2O2’nin yoğunluğu, çeşitli çözücülerdeki çözünürlüğünün belirlenmesinde de önemlidir.
Potasyum Peroksit Molekül Ağırlığı
K2O2’nin moleküler ağırlığı 110,2 g/mol’dür. Bu değer molekülde bulunan tüm atomların atom ağırlıklarının toplamıdır. Molekül ağırlığı, bir maddenin molar kütlesi ve yoğunluğu da dahil olmak üzere çeşitli özelliklerini hesaplamak için kullanılan önemli bir özelliktir.
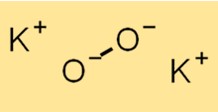
Potasyum peroksitin yapısı
K2O2’nin yapısı bir K+ katyonu ve bir O2^2- anyonundan oluşur. O2^2- anyonu birbirine kovalent olarak bağlanmış iki oksijen atomundan oluşur. K2O2’nin yapısı kimyasal özelliklerini ve reaktivitesini anlamak için gereklidir.
| Dış görünüş | Beyaz ila soluk sarı katı |
| Spesifik yer çekimi | 2.08 |
| Renk | Beyazdan soluk sarıya |
| Koku | Kokusuz |
| Molar kütle | 110,2 g/mol |
| Yoğunluk | 2,08 gr/ml |
| Füzyon noktası | 655°C |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Suyla reaksiyona girer |
| çözünürlük | Organik çözücülerde çözünmez |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Uygulanamaz |
Potasyum Peroksit Güvenliği ve Tehlikeleri
K2O2, güçlü oksitleyici özellikleri nedeniyle çeşitli güvenlik riskleri taşır. Su veya nem ile kuvvetli bir şekilde reaksiyona girerek oksijen gazı açığa çıkarabilir ve ısı üretebilir. Bu reaksiyon, doğru şekilde müdahale edilmediği takdirde potansiyel olarak yangına veya patlamaya neden olabilir. Ayrıca temas halinde ciltte ve gözlerde tahrişe neden olabilir ve tozunun solunması solunum sorunlarına neden olabilir. K2O2’nin dikkatli bir şekilde kullanılması, uygun kişisel koruyucu ekipman giyilmesi ve serin, kuru bir yerde, ısı kaynaklarından ve uyumsuz malzemelerden uzakta saklanması önemlidir. Kazara maruz kalma durumunda derhal tıbbi yardıma başvurun.
| Tehlike sembolleri | Oksitleyici ajan |
| Güvenlik Açıklaması | Suya maruz bırakmayın. Koruyucu eldiven ve göz/yüz koruması kullanın. Serin ve kuru bir yerde, ısı kaynaklarından ve uyumsuz malzemelerden uzakta saklayın. |
| BM kimlik numaraları | UN1504 |
| HS kodu | 2829.90.90 |
| Tehlike sınıfı | 5.1 |
| Paketleme grubu | II |
| Toksisite | Cilt ve göz tahrişine neden olabilir. Tozun solunması solunum sorunlarına neden olabilir. |
Potasyum peroksit sentez yöntemleri
Potasyum hidroksitin hidrojen peroksit ile reaksiyonu, potasyum hidroksitin baryum peroksit ile reaksiyonu ve potasyum süperoksitin termal ayrışması dahil olmak üzere K2O2’yi sentezlemek için çeşitli yöntemler vardır.
İlk yöntem, beyaz bir K2O2 çökeltisi oluşana kadar karıştırırken bir hidrojen peroksit çözeltisine yavaş yavaş potasyum hidroksit eklemeyi içerir. İşlem, karışımın filtrelenmesini ve safsızlıkların giderilmesi için katının soğuk suyla yıkanmasını içerir.
İkinci yöntemde, bir potasyum hidroksit çözeltisi eklerken bir baryum peroksit süspansiyonunu karıştırın. Karışımı süzün ve süzüntüyü kuruyana kadar buharlaştırın. Daha sonra, kalan baryum peroksiti ayrıştırmak ve K2O2 oluşturmak için elde edilen katıyı yüksek bir sıcaklığa ısıtın.
Üçüncü yöntem, potasyum süperoksitin yüksek bir sıcaklığa ısıtılmasını ve bunun K2O2 ve oksijen gazına ayrışmasını sağlamayı içerir.
Potasyum Peroksitin Kullanım Alanları
K2O2’nin oksitleyici özelliklerinden dolayı çeşitli endüstrilerde çeşitli kullanımları vardır. Kullanımlarından bazıları şunlardır:
- Ağartıcı: Tekstil ve kağıt ürünleri ile saç ve diş beyazlatma ürünlerinde ağartma maddesi olarak kullanılır.
- Oksijen Kaynağı: Denizaltı gibi kapalı sistemlerde, su ile karıştığında oksijen açığa çıkarabilen oksijen kaynağı olarak kullanılır.
- Polimerizasyon: Polistiren sentezinde olduğu gibi, polimer üretmek için belirli monomerlerin polimerizasyonunda kullanılır.
- Toprak İyileştirme: Petrol sızıntısı gibi organik kirleticileri gidermek amacıyla toprak iyileştirme için kullanılır.
- Analitik Kimya: Analitik kimyada belirli bileşiklerin varlığını belirlemek için oksitleyici bir madde olarak kullanılır.
- Roket Yakıtı: Oksijen salma özelliğinden dolayı roket yakıtında oksitleyici olarak kullanılır.
- Kimyasal sentez: Potasyum permanganatın sentezi gibi çeşitli organik ve inorganik bileşiklerin sentezinde kullanılır.
Sorular:
S: Hangisi daha iyi, hidrojen peroksit mi yoksa potasyum hidroksit mi?
Cevap: Kullanım amacına bağlıdır. Hidrojen peroksit güçlü bir oksitleyici maddedir ve yaygın olarak dezenfektan, ağartıcı, saç ve diş beyazlatıcı olarak kullanılır. Potasyum hidroksit ise güçlü bir baz olup sabun ve deterjan üretiminde yaygın olarak kullanıldığı gibi bitkisel yağlardan biyodizel üretiminde de yaygın olarak kullanılmaktadır.
S: Potasyum süperoksit, potasyum peroksit ve potasyum oksidin kimyasal formülleri nelerdir?
C: Kimyasal formüller potasyum süperoksit için K2O2, potasyum peroksit için K2O2 ve potasyum oksit için K2O’dur.
S: Hidrojen peroksit, potasyum iyodür ve iyodat ile reaksiyona girdiğinde ne oluşur?
C: Hidrojen peroksit, potasyum iyodür ve iyodat ile reaksiyona girdiğinde, aşağıdaki reaksiyona göre iyot üretilir: H2O2 + KI + KIO3 → I2 + K2O + H2O.
Soru: K2O2’deki oksijen atomunun oksidasyon numarası nedir?
C: K2O2’deki oksijen atomunun oksidasyon sayısı -1’dir.
Soru: K2O2’deki K’nin oksidasyon sayısı nedir?
C: K2O2’deki K’nin oksidasyon sayısı +1’dir.
