Potasyum bikarbonat (KHCO3) beyaz kristalli bir tuz olarak hizmet eder; yaygın olarak fırıncılıkta ayırıcı madde olarak, yangın söndürücü madde olarak ve tarımda toprak asitliğini nötralize etmek için kullanılır. Ayrıca besin takviyesi görevi görür ve belirli tıbbi tedavilerde rol oynar.
| IUPAC Adı | Potasyum hidrojen karbonat |
| Moleküler formül | KHCO3 |
| CAS numarası | 298-14-6 |
| Eş anlamlı | Potasyum hidrojen karbonat, potasyum asit tuzu, potasyum hidrojen karbonat, PCN 0775, E501 |
| InChI | InChI=1S/CH2O3.K/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1 |
Potasyum bikarbonatın özellikleri
Potasyum Bikarbonat Formülü
Potasyum bikarbonatın formülü KHCO3’tür. Bu formül, bir potasyum iyonunun (K+) bir bikarbonat iyonu (HCO3-) ile birleşerek bir potasyum bikarbonat molekülü oluşturduğunu gösterir. Formül kimyada önemlidir çünkü bir molekülü oluşturan atomların türleri ve sayısı hakkında bilgi sağlar.
Potasyum Bikarbonat Molar Kütlesi
KHCO3’ün molar kütlesi 100.115 g/mol’dür. Bu, bir mol KHCO3’ün 100.115 gram bileşik içerdiği anlamına gelir. Molar kütle bir bileşiğin önemli bir özelliğidir çünkü kimyasal reaksiyon için gerekli olan madde miktarını hesaplamak için kullanılır. Ek olarak, bir maddenin gramını ve molünü dönüştürmek için molar kütle kullanılabilir.
Potasyum bikarbonatın kaynama noktası
KHCO3’ün kaynama noktası, kaynama noktasına ulaşmadan ayrıştığı için iyi tanımlanmamıştır. KHCO3 ısıtıldığında potasyum karbonat, karbondioksit ve suya ayrışır. Bu nedenle KHCO3’ün bozunma sıcaklığı onun termal kararlılığını tanımlamak için kullanılır.
Potasyum Bikarbonat Erime Noktası
KHCO3’ün erime noktası 292°C’dir. Bu sıcaklıkta KHCO3 katı halden sıvı hale dönüşür. Bir bileşiğin erime noktası önemli bir fiziksel özelliktir çünkü bileşiğin eritilip işlenebileceği koşulları belirler.
Potasyum bikarbonatın yoğunluğu g/mL
KHCO3’ün yoğunluğu 2,17 g/mL’dir. Yoğunluk birim hacim başına kütle miktarının bir ölçüsüdür. KHCO3’ün yüksek yoğunluğu, onu B Sınıfı yangınları söndürmek için kullanıldığı yangın söndürücüler gibi uygulamalarda yararlı bir bileşik haline getirir.
Potasyum Bikarbonat Molekül Ağırlığı
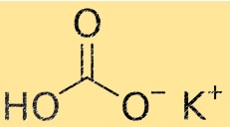
KHCO3’ün moleküler ağırlığı 100.115 g/mol’dür. Molekül ağırlığı, bir moleküldeki tüm atomların atom ağırlıklarının toplamıdır. Bu özellik kimyada önemlidir çünkü kimyasal reaksiyon için gerekli olan madde miktarını hesaplamak için kullanılır.
Potasyum bikarbonatın yapısı
KHCO3, sodyum klorüre benzer bir kristal yapıya sahiptir. Bileşik potasyum iyonlarından (K+) ve bikarbonat iyonlarından (HCO3-) oluşur. Potasyum iyonları, sodyum klorürün kristal yapısında sodyum iyonlarının konumlarını işgal ederken bikarbonat iyonları, klorür iyonlarının konumlarını işgal eder.
| Dış görünüş | Beyaz kristal toz |
| Spesifik yer çekimi | 2,17 g/cm³ |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 100.115 gr/mol |
| Yoğunluk | 2,17 g/cm³ |
| Füzyon noktası | 292°C |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 25g/100ml (20°C) |
| çözünürlük | Suda çözünebilir |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 10.3 (karbonik asit) |
| pH | 8,5 – 9,5 (%1’lik çözüm) |
Potasyum bikarbonatın güvenliği ve tehlikeleri
KHCO3, belirtildiği şekilde kullanıldığında genellikle güvenli kabul edilir. Ancak ciltte ve gözde tahrişe neden olabilir ve dikkatli kullanılmalıdır. Büyük miktarlarda yutulması halinde de zararlı olabilir. Tozun solunması solunum yolu tahrişine neden olabilir. Ayrıca güçlü asitlerle reaksiyona girerek tehlikeli olabilecek karbondioksit açığa çıkarabilir. KHCO3 kullanırken güvenlik prosedürlerine uymak ve uygun koruyucu ekipman giymek önemlidir. Yutulması halinde derhal tıbbi yardıma başvurun. Cilt veya gözlerle teması halinde, etkilenen bölgeyi suyla iyice yıkayın ve tahrişin devam etmesi halinde tıbbi yardım alın.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Yutulması halinde zararlıdır, cilt ve göz tahrişine neden olur. Teneffüs etmekten kaçının. |
| BM kimlik numaraları | BM 2987 |
| HS kodu | 2836.30.00 |
| Tehlike sınıfı | 8 (Aşındırıcı) |
| Paketleme grubu | III |
| Toksisite | LD50 (sıçan, ağızdan): 6.400 mg/kg |
Potasyum bikarbonatın sentezi için yöntemler
Suyun varlığında karbondioksit, potasyum karbonatla reaksiyona girerek KHCO3’ü sentezler.
Reaksiyon şu şekilde gerçekleşir:
K2CO3 + CO2 + H2O → 2KHCO3
Başka bir yöntem , potasyum hidroksitin karbon dioksitle reaksiyona sokulmasıdır:
KOH + CO2 → KHCO3
Elde edilen KHCO3 daha sonra sudan yeniden kristalleştirme yoluyla saflaştırılabilir. Reaksiyon verimi ham maddelerin saflığına ve reaksiyon koşullarına bağlıdır.
KHCO3 üretmek için potasyum klorür amonyum bikarbonatla reaksiyona sokulabilir, ardından karbondioksit ile işlenebilir.
NH4HCO3 + KCl → NH4Cl + KHCO3
KHCO3 + CO2 → K2CO3 + H2O
K2CO3 + CO2 + H2O → 2KHCO3
Bu yöntem ucuz hammadde kullanma avantajına sahiptir ve herhangi bir tehlikeli yan ürün üretmez.
Potasyum Bikarbonatın Kullanım Alanları
KHCO3’ün çeşitli endüstrilerde ve uygulamalarda geniş bir kullanım alanı vardır. İşte en yaygın kullanımlardan bazıları:
- Gıda endüstrisi: Kek, kurabiye ve ekmek gibi unlu mamullerde kabarmaya yardımcı olmak için ayırıcı madde olarak kullanılır.
- Tarım: Külleme gibi mantar bitki hastalıklarını kontrol etmek için fungisit olarak kullanılır.
- Farmasötikler: Mide asidini nötralize etmek ve hazımsızlık ve mide yanmasını tedavi etmek için antiasitlerde kullanılır.
- Yangın Söndürücüler: Yangın söndürücülerde B Sınıfı ve C Sınıfı yangınları söndürmek için kuru kimyasal madde olarak kullanılır.
- Laboratuvar Uygulamaları: pH tamponlama ve hücre kültürü gibi çeşitli laboratuvar uygulamalarında kullanılır.
- Kişisel bakım ürünleri: Diş macunlarında hafif aşındırıcı olarak ve deodorantlarda koku kontrolüne yardımcı olmak için kullanılır.
- Su Arıtma: Su arıtımında pH seviyesini ayarlamak ve ağır metalleri ve diğer yabancı maddeleri uzaklaştırmak için kullanılır.
Sorular:
Soru: Potasyum bikarbonat nedir?
C: KHCO3 gıda, tarım ve ilaç gibi çeşitli endüstrilerde yaygın olarak kullanılan beyaz, kokusuz bir tozdur. KHCO3 kimyasal formülüne sahiptir ve potasyum katyonu, bikarbonat anyonu ve su moleküllerinden oluşan bir tuzdur.
Soru: Potasyum efervesan tabletlerdeki bikarbonat karbondioksite dönüşür mü?
C: Evet, potasyum efervesan tabletler suda çözündüğünde, tabletteki bikarbonat sitrik asitle reaksiyona girerek karbondioksit açığa çıkarır. Bu reaksiyon, efervesan tabletlere özgü karakteristik köpürme ve kabarcıklanma üretir.
S: Şaraba potasyum bikarbonat ekledikten sonra ne olur?
SAHİP OLMAK: Şaraba KHCO3 eklenmesi, mevcut fazla asitle reaksiyona girerek şarabın asitliğini azaltır. Şarap üreticileri, şarabın tadını ve kalitesini iyileştirmek için asit giderme adı verilen bu işlemi yaygın olarak kullanırlar.
S: Potasyum bikarbonat nereden alınır?
C: KHCO3 çeşitli kimyasal tedarikçilerinden, çevrimiçi pazarlardan ve tarımsal malzeme mağazalarından satın alınabilir. Aynı zamanda sağlıklı gıda mağazalarında ve sağlıklı gıda pazarlarında da yaygın olarak bulunur.
Soru: Formülü KHCO3 olan bileşiğin adı nedir?
C: KHCO3 formülüne sahip bileşiğe potasyum bikarbonat denir.
S: KHCO3’ün tamamının reaksiyona girdiğinden emin olmak için deneyde ne yapıldı?
C: Deneyde KHCO3’ün tamamının reaksiyona girdiğinden emin olmak için reaksiyon karışımına fazla asit ilave edildi ve reaksiyon, artık gaz üretilmeyene kadar sürdürüldü. Gazın yokluğu, KHCO3’ün tamamının asitle reaksiyona girdiğini gösterdi.
S: KHCO3’ü ısıtırsanız ne olur?
C: KHCO3 ısıtıldığında ayrışarak potasyum karbonat (K2CO3), su ve karbondioksit oluşturur. Bu reaksiyon şu şekilde gerçekleşir: 2KHCO3 → K2CO3 + H2O + CO2.
